题目内容
14.CO2是重要的化工原料,也是应用广泛的化工产品.CO2与过氧化钠或超氧化钾反应可产生氧气.完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解.2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为89.6L(标准状况).
(2)某H2中含有2.40molCO2,该混合气体通入2.00L NaOH溶液中,CO2被完全吸收.如果NaOH完全反应,该NaOH溶液的浓度为2.4mol/L≥c≥1.2mol/L.
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9mol CO2在密封舱内和KO2反应后生成9mol O2,则反应前密封舱内H2O的量应该是多少?列式计算.
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O$→_{△}^{催化剂}$CO+3H2
已知:CO+2H2$→_{△}^{催化剂}$CH3OH CO2+3H2$→_{△}^{催化剂}$CH3OH+H2O
300mol CH4完全反应后的产物中,加入100mol CO2后合成甲醇.若获得甲醇350mol,残留氢气120mol,计算CO2的转化率.
分析 (1)NH4HCO3完全分解生成NH3、CO2,方程式为NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O,2molNH4HCO3可生成4mol气体;
(2)2.40molCO2与NaOH完全反应,产物可能为Na2CO3或NaHCO3或二者都有,结合质量守恒解答;
(3)9 mol CO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2):n(O2)=1:1,当把两个方程式相加得到8KO2+6CO2+2H2O→2K2CO3+4KHCO3+6O2,根据方程式计算消耗水的量;
(4)甲烷完全反应生成CO和氢气,根据反应CO+2H2$→_{△}^{催化剂}$CH3OH、CO2+3H2$→_{△}^{催化剂}$CH3OH+H2O设CO2的转化率为α,CO的转化率为β,结合质量守恒可计算转化率;或根据氢元素守恒计算.
解答 解:(1)NH4HCO3完全分解生成NH3、CO2,方程式为NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O,分解后水为液态,则2molNH4HCO3可生成4mol气体,体积为4mol×22.4L/mol=89.6L,故答案为:89.6;
(2)2.40molCO2与NaOH完全反应,产物可能为Na2CO3或NaHCO3或二者都有,
假设全部生成生成NaHCO3,则发生CO2+NaOH=NaHCO3,n(NaOH)=n(CO2)=2.40mol,则c(NaOH)=$\frac{2.4mol}{2.00L}$=1.20mol/L;
假设全部生成,则发生CO2+2NaOH=Na2CO3,n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)=$\frac{4.80mol}{2.00L}$=2.40mol/L;
综合以上两种情况可知,NaOH溶液的浓度应该1.20mol/L≤c(NaOH)≤2.40mol/L.
故答案为:2.4 mol/L≥c≥1.2 mol/L;
(3)可用两种方法解答:
方法一:依题意,9 mol CO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2):n(O2)=1:1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:8KO2+6CO2+2H2O→2K2CO3+4KHCO3+6O2
所以有n(H2O)=$\frac{1}{3}$n(CO2)=$\frac{1}{3}$×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol,
方法二:设反应前密封舱内H2O的物质的量为n
4KO2+4CO2+2H2O→4KHCO3+3O2
2n n 1.5n
4KO2+2CO2→2K2CO3+3O2
9-2n 1.5(9-2n)
根据题意生成氧气9mol,所以有1.5n+1.5(9-2n)=9mol,解得n=3mol,即反应前密封舱内H2O的物质的量为3mol.
答:反应前密封舱内H2O的量应该是3mol;
(4)方法一:
CH4+H2O→CO+3H2
300mol 300mol 900mol
设CO2的转化率为α,CO的转化率为β
CO+2H2→CH3OH CO2+3H2→CH3OH+H2O
300βmol 600βmol 300βmol 100αmol 300αmol 100αmol
根据题意,共生成350mol甲醇,所以有300βmol+100αmol=350mol-------①
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-120mol,所以有
600βmol+300αmol=900mol-120mol--------②
由①②式可得α=0.8,即设CO2的转化率为80%.
方法二:
在合成甲醇的反应中,氢元素在生成物中有两种存在形式,一是存在于甲醇中,二是存在于水中,设CO2的转化率为α,
CH4+H2O→CO+3H2
300mol 900mol
CO2+3H2→CH3OH+H2O
100amol 100amol
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-120mol,根据反应中氢元素的守恒可有900mol-120mol=350mol×2+100amol,
解得a=0.8,
即设CO2的转化率为80%,
答:CO2的转化率为80%.
点评 本题考查化学方程式的计算,综合考查学生的分析、计算能力,题目用到端值法和守恒法,难度较大,易错点为(4)答题时注意体会.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 的准确命名是( )
的准确命名是( )| A. | 3,3二甲基-4-乙基戊烷 | B. | 3,3,4-三甲基已烷 | ||
| C. | 3,3,4,-三甲基已烷 | D. | 2,3,3-三甲基已烷 |
| A. | 氧化镁中混有氧化铝 | B. | 氯化铝溶液中混有氯化铁 | ||
| C. | 氧化铁中混有二氧化硅 | D. | 氯化亚铁溶液中混有氯化铜 |
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
| v正 | v逆 | 平衡常数K | 转化率α |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1mol/L Na2CO3溶液的pH大于0.1mol/L Na2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸.若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是ac.(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]b.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]d.[H2CO3]>[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++HCO3-?H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变.
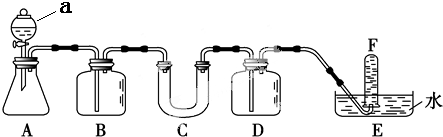
(1)写出仪器a的名称分液漏斗.
(2)A是实验室制取CO2的装置.写出A中发生反应的离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+.
(3)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和碳酸氢钠溶液 | |
| D |
(5)若将钠和过氧化钠的混合物12.4g与足量的水反应后,生成的气体在电火花用下恰好完全反应,且所得溶液的体积为100mL,则所得溶液的物质的量浓度是4mol•L-1.
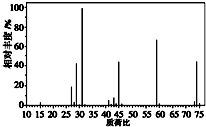 根据以下有关信息确定有机物的组成
根据以下有关信息确定有机物的组成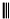 +
+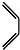 $\stackrel{△}{→}$
$\stackrel{△}{→}$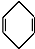 如果要合成
如果要合成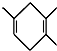 ,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.
,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3. 3,5,5-三甲基辛烷
3,5,5-三甲基辛烷 3,4,4-三甲基-1-戊炔
3,4,4-三甲基-1-戊炔 1,3-二氯戊烷
1,3-二氯戊烷 1-甲基-4-乙基苯
1-甲基-4-乙基苯

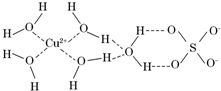 第四周期的许多金属能形成配合物.科学家通过X射线测得胆矾结构示意图可简单表示如下:
第四周期的许多金属能形成配合物.科学家通过X射线测得胆矾结构示意图可简单表示如下: