题目内容
9.X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.在周期表中,X与Y相邻;Y原子的最外层电子数是其内层电子数的3倍;Z是第三周期中简单离子半径最小的元素;W与Y位于同一主族.下列说法正确的是( )| A. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| B. | Z和Q形成的化合物为离子化合物 | |
| C. | 不存在由元素Z与元素W形成的化合物的水溶液 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
分析 Y原子的最外层电子数是其内层电子数的3倍,所以Y是氧元素,则X是氮元素,Z是第三周期中简单离子半径最小的元素,所以Z是铝元素,W与Y位于同一主族,所以W是硫元素,而X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素,则Q是氯元素,由此分析解答.
解答 解:A、电子层数越多半径越大,电子层数相同核电荷数越多半径越小,所以rZ>rW>rQ>rX>rY,故A错误;
B、氯化铝是共价化合物,故B错误;
C、硫化铝只能在干态中存在,在溶液中转化为氢氧化铝和硫化氢,故C正确;
D、非金属性越强最高价氧化物对应水化物的酸性越强,非金属性Cl>S,所以元素W的最高价氧化物对应的水化物的酸性比Q的弱,故D错误;
故选C.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,C选项中注意硫化铝的工业制法.

练习册系列答案
相关题目
17.设NA代表阿伏加德罗常数,下列说法不正确的是( )
| A. | 1.7gH2O2中含有的电子总数为0.9NA | |
| B. | 92g NO2和N2O4的混合气中含有的氮原子数为2NA | |
| C. | 标准状况下,28 g CO与22.4 L O2所含原子数相等 | |
| D. | 1 mol FeCl3完全水解转化为氢氧化铁胶体后生成NA个胶粒 |
14.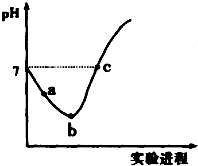 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| D. | c 点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
1.我国西部地区有丰富的盐湖资源,对盐湖矿产资源的综合开发利用是西部大开发的重要课题之一.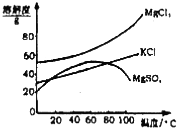
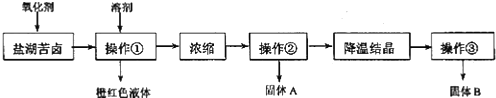
I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
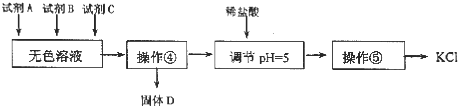
II.某同学提出了另一种新方案,对上述操作①后无色溶液进行除杂提纯,无色溶液中先 加试剂 A,再加试剂 B,最后加试剂 C(常见的盐),其方案如下:
下列说法不正确的是( )

I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:

II.某同学提出了另一种新方案,对上述操作①后无色溶液进行除杂提纯,无色溶液中先 加试剂 A,再加试剂 B,最后加试剂 C(常见的盐),其方案如下:

下列说法不正确的是( )
| A. | 要从橙红色液体中分离出单质溴,可采取的操作是蒸馏 | |
| B. | 操作②为过滤,主要目的是为了除去 MgSO4 | |
| C. | 试剂 C为K2CO3,固体D主要为Mg(OH)2、BaSO4,还有少量的BaCO3 | |
| D. | 若在操作④结束后发现溶液略有浑浊,应采取的措施是更换滤纸,重新过滤 |
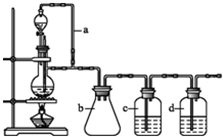
2.在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用如图中的实验装置进行实验,证明过氧化钠可作供氧剂.
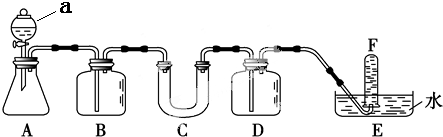
(1)写出仪器a的名称分液漏斗.
(2)A是实验室制取CO2的装置.写出A中发生反应的离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+.
(3)填写表中空格:
(4)写出仪器C中主要反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(5)若将钠和过氧化钠的混合物12.4g与足量的水反应后,生成的气体在电火花用下恰好完全反应,且所得溶液的体积为100mL,则所得溶液的物质的量浓度是4mol•L-1.

(1)写出仪器a的名称分液漏斗.
(2)A是实验室制取CO2的装置.写出A中发生反应的离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+.
(3)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和碳酸氢钠溶液 | |
| D |
(5)若将钠和过氧化钠的混合物12.4g与足量的水反应后,生成的气体在电火花用下恰好完全反应,且所得溶液的体积为100mL,则所得溶液的物质的量浓度是4mol•L-1.

 根据以下有关信息确定有机物的组成
根据以下有关信息确定有机物的组成 +
+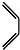 $\stackrel{△}{→}$
$\stackrel{△}{→}$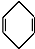 如果要合成
如果要合成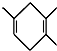 ,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.
,所用的起始原料的结构简式为C(CH3)2=C(CH3)2、CH3C≡CH或CH2=C(CH3)-CH=CH2、CH3C≡CCH3.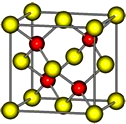 有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题: .
.