题目内容
9.现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| X | M层的电子数为K层电子数的3倍 |
| Y | 短周期中最活泼的金属元素 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 元素最高正价是+7价 |
(2)元素Z的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键和共价键;
(3)元素X与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是de;
a.常温下X的单质和T的单质状态不同
b.X的氢化物比T的氢化物稳定
c.X的单质与H2化合比T的单质与H2化合更容易
d.T的单质可以把X单质从它的氢化物中置换出来
e.X的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性弱
(4)写出T的单质与元素Y的最高价氧化物所对应的水化物反应的离子方程式2OH-+Cl2=Cl-+ClO-+H2O.
分析 均为短周期元素,由X的M层的电子数为K层电子数的3倍,则X为S元素;Y为短周期中最活泼的金属元素,Y为Na;常温下Z的单质为双原子分子,其氢化物水溶液呈碱性,Z为N;T元素最高正价是+7价,则T为Cl,以此来解答.
解答 解:由上述分析可知,X为S,Y为Na,Z为N,T为Cl,
(1)元素X在元素周期表中的位置为第三周期ⅥA族,故答案为:第三周期ⅥA族;
(2)元素Z的最高价氧化物对应水化物与其氢化物能生成盐M为硝酸铵,M中含有的化学键类型有离子键和共价键,故答案为:离子键和共价键;
(3)元素X与元素T相比,非金属性较强的是Cl,可利用氢化物的稳定性、与氢气化合的难易程度、单质之间的置换反应、最高价氧化物所对应的水化物的酸性比较非金属性,只有de符合,非金属性与物质的状态无关,bc与非金属性强弱不符,
故答案为:Cl;de;
(4)T的单质与元素Y的最高价氧化物所对应的水化物反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O,故答案为:2OH-+Cl2=Cl-+ClO-+H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、原子结构、元素化合物知识等来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
17.能表示阿伏加德罗常数的数值是( )
| A. | 1mol金属钠含有的电子数 | |
| B. | 标准状况下,22.4L酒精所含的分子数 | |
| C. | 12g12C所含的原子数 | |
| D. | 1L 1mol/L的硫酸溶液中所含的H+ |
4. 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
(1)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
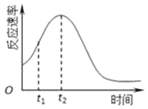
(2)双鸭山市第一中学高二化学兴趣小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①此反应放热,温度升高,化学反应速率加快;②生成物中的锰离子(或硫酸锰)为此反应的催化剂.
(3)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=3,C=100,E=20
(4)若t1<t2,则根据实验①和②得到的结论是其他条件相同时,溶液的初始pH越小,该反应的反应速率越快.
 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.(1)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(2)双鸭山市第一中学高二化学兴趣小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①此反应放热,温度升高,化学反应速率加快;②生成物中的锰离子(或硫酸锰)为此反应的催化剂.
(3)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=3,C=100,E=20
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 40 | 100 | 60 | t1 |
| ② | 常温 | A | B | C | 60 | t2 |
| ③ | 常温 | 3 | 80 | D | E | t3 |
14.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 18g2H2O中含有的电子数目为NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离+数为0.05NA | |
| C. | 常温常压,22.4LC12中含有的分子数为6.02×1023个 | |
| D. | 常温常压下,足量的金属Al与lmolCl2共热,转移电子数为2NA |
1.氯气是一种重要的工业原料.工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1 mol N2有3 mol 电子转移 | D. | 该反应不属于复分解反应 |
18.X、Y、Z、W四种短周期元素的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族,下列叙述正确的是( )
| A. | X只能形成一种氧化物 | |
| B. | 化合物YX比WX3的熔点高 | |
| C. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| D. | 原子半径的大小顺序:r(X)<r(Y)<r(Z)<r(W) |
19.化学在古代与现代的科技发展中起了十分重要的作用,下列说法中正确的是( )
 |  |  |  |
| 古代与现代的冶金均运用了相同的化学原理 | 古代与现代的火箭发射均利用了液体燃料 | 古代捣碎中药与现代中药纳米粉碎均是化学变化 | 古代风筝与现代热气球飞行均无需物质直接供给能量 |
| A. | A | B. | B | C. | C | D. | D |