题目内容
4. 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.(1)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
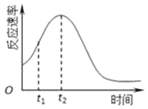
(2)双鸭山市第一中学高二化学兴趣小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①此反应放热,温度升高,化学反应速率加快;②生成物中的锰离子(或硫酸锰)为此反应的催化剂.
(3)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=3,C=100,E=20
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 40 | 100 | 60 | t1 |
| ② | 常温 | A | B | C | 60 | t2 |
| ③ | 常温 | 3 | 80 | D | E | t3 |
分析 (1)草酸与高锰酸钾反应是锰离子和二氧化碳、水;
(2)根据外界条件对化学反应速率的影响;
(3)根据该实验探究不同的初始pH和草酸溶液浓度对反应速率的影响,所以KMnO4的浓度不变,探究外界条件对反应速率的影响,需保证其他条件相同时来实验;
(4)实验①和②只有pH不同,其它条件都相同;
解答 解:(1)草酸与高锰酸钾反应是锰离子和二氧化碳、水,其反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
(2)对于该反应,影响化学反应的速率只有温度和催化剂,所以反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:反应放热,温度升高或产物Mn2+是反应的催化剂;
故答案为:此反应放热,温度升高,化学反应速率加快;生成物中的锰离子(或硫酸锰)为此反应的催化剂;
(3)根据该实验探究不同的初始pH和草酸溶液浓度对反应速率的影响,实验要求控制KMnO4溶液初始浓度相同,则KMnO4溶液的体积为100mL,总体积为200mL,则C=100,D=100,B=40,E=20,探究外界条件对反应速率的影响,需保证其他条件相同,则①与②的pH不同,②与③的草酸浓度不同,
则A=3,
故答案为:3;100;20;
(4)实验①和②只有pH不同,其它条件都相同,而且t1<t2,说明其他条件相同时,溶液的初始pH越小,该反应的反应速率越快;
故答案为:其他条件相同时,溶液的初始pH越小,该反应的反应速率越快;
点评 本题主要结合实验考查了影响化学反应速率的因素,题目难度中等,注意温度、浓度、催化剂对化学反应速率的影响,在探究外界条件对反应速率的影响时,必须保证其他影响反应速率的条件一致.

| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | ||
| 1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理:2KMnO4+5H2C2O4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O.
(2)根据表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度,反应速率增大.
(3)利用实验3中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=1.5×10-2mol/(L•min).
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.

该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
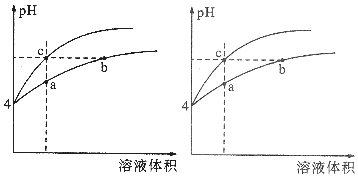 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
| 元素编号 | 元素性质或原子结构 |
| X | M层的电子数为K层电子数的3倍 |
| Y | 短周期中最活泼的金属元素 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 元素最高正价是+7价 |
(2)元素Z的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键和共价键;
(3)元素X与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是de;
a.常温下X的单质和T的单质状态不同
b.X的氢化物比T的氢化物稳定
c.X的单质与H2化合比T的单质与H2化合更容易
d.T的单质可以把X单质从它的氢化物中置换出来
e.X的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性弱
(4)写出T的单质与元素Y的最高价氧化物所对应的水化物反应的离子方程式2OH-+Cl2=Cl-+ClO-+H2O.
| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.(2)D的最低价含氧酸的电子式
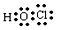 .
.(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.(产物中无有毒有害物质)
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质.该反应的化学方程式:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=HClO+Cl-+HCO3-.
| A. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| B. | 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H>0,△S<0 | |
| D. | 将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深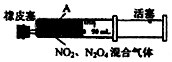 |
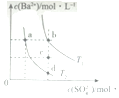
| A. | T1时,c点有沉淀生成 | |
| B. | T2时,蒸发溶剂可能由d点变到b点 | |
| C. | T2时,由a点开始加入BaCl2固体,Ksp增大 | |
| D. | BaSO4的溶解度随温度升高而增大 |
