题目内容
17.能表示阿伏加德罗常数的数值是( )| A. | 1mol金属钠含有的电子数 | |
| B. | 标准状况下,22.4L酒精所含的分子数 | |
| C. | 12g12C所含的原子数 | |
| D. | 1L 1mol/L的硫酸溶液中所含的H+ |
分析 A、钠原子中含11个电子;
B、标况下酒精为液体;
C、12C的摩尔质量为12g/mol,求出12C的物质的量,然后根据原子个数N=nNA来计算;
D、求出硫酸的物质的量,然后根据硫酸能电离出2个氢离子来分析.
解答 解:A、钠原子中含11个电子,故1mol钠中含11mol即11NA个电子,故A错误;
B、标况下酒精为液体,故 22.4L酒精的物质的量大于1mol,则分子个数大于NA个,故B错误;
C、12C的摩尔质量为12g/mol,故12g12C的物质的量为1mol,则原子个数N=nNA=NA个,故C正确;
D、1mol/L1L硫酸溶液中硫酸的物质的量n=CV=1mol/L×1L=1mol,而硫酸能电离出2个氢离子,且水也能电离出少量的氢离子,故1mol硫酸溶液中氢离子个数多于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.某反应的反应热△H=+100kJ/mol.下列有关该反应的叙述正确的是( )
| A. | 正反应的活化能小于100kJ/mol | |
| B. | 逆反应活化能一定小于100kJ/mol | |
| C. | 正反应活化能小于100kJ/mol | |
| D. | 正反应活化能比逆反应活化能大100kJ/mol |
12.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,进行了如下实验:
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理:2KMnO4+5H2C2O4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O.
(2)根据表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度,反应速率增大.
(3)利用实验3中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=1.5×10-2mol/(L•min).
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.

该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | ||
| 1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理:2KMnO4+5H2C2O4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O.
(2)根据表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度,反应速率增大.
(3)利用实验3中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=1.5×10-2mol/(L•min).
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.

该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
2.酸性 KMnO4溶液能与草酸(H2C2O4)溶液反应.某化学探究小组利用反应过程中溶液紫色消失快慢的 方法来研究影响反应速率的因素.
I.实验前首先用浓度为 0.1000mol/L 酸性 KMnO4标准溶液滴定未知浓度的草酸溶液.
(1)写出滴定过程中发生反应的离子方程式 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)下列有关一定物质的量浓度溶液配制的说法中正确的是 C.
A.把 15.8g KMnO4固体溶于 1L 水中所得溶液物质的量浓度为 0.1mol/L
B.把 0.01mol KMnO4固体投入 100mL 容量瓶中加水至刻度线,充分振荡后,浓度为 0.1mol/L C.需要 90mL 0.1mol/L 的 KMnO4溶液,应准确称量 KMnO4 固体 1 58g
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏高
II.通过滴定实验得到草酸溶液的浓度为 0.2000mol/L.用该草酸溶液按下表进行后续实验(每次实验草酸溶液 的用量均为 8.00mL).
(3)写出表中实验 1 和实验 2 的实验目的: 探究温度不同对反应速率的影响.
(4)该小组同学对实验 1 和实验 3 分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
分析上述数据后得出“其他条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就
越快”的结论.甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到 了 错 误 的 实 验 结 论,甲 同 学 改 进 了 实 验 方 案,请 简 述 甲 同 学 改 进.
(5)该实验中使用的催化剂应选择 MnSO4并非 MnCl2,原因可用离子方程式表示为 2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
III.工业上可用软锰矿(主要成分为 MnO2)经下列生产过程制备高锰酸钾.
①由软锰矿提取得到 MnO2,然后在 MnO2、KOH 的熔融混合物中通入空气可制得锰酸钾(K2MnO4);
②向锰酸钾溶液中通入 CO2 可获得高锰酸钾.
(6)第①步生产过程中,在熔融混合物中通入空气时发生反应的化学方程式:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(7)向锰酸钾溶液中通入CO2可获得高锰酸该反应中氧化产物与还原产物的物质的量之比为2:1.
I.实验前首先用浓度为 0.1000mol/L 酸性 KMnO4标准溶液滴定未知浓度的草酸溶液.
(1)写出滴定过程中发生反应的离子方程式 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)下列有关一定物质的量浓度溶液配制的说法中正确的是 C.
A.把 15.8g KMnO4固体溶于 1L 水中所得溶液物质的量浓度为 0.1mol/L
B.把 0.01mol KMnO4固体投入 100mL 容量瓶中加水至刻度线,充分振荡后,浓度为 0.1mol/L C.需要 90mL 0.1mol/L 的 KMnO4溶液,应准确称量 KMnO4 固体 1 58g
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏高
II.通过滴定实验得到草酸溶液的浓度为 0.2000mol/L.用该草酸溶液按下表进行后续实验(每次实验草酸溶液 的用量均为 8.00mL).
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | |
| 体积(mL) | 浓度(mol/L) | |||
| 1 | 25 | 0.5 | 4.00 | 0.1000 |
| 2 | 50 | 0.5 | 4.00 | 0.1000 |
| 3 | 25 | 0.5 | 4.00 | 0.0100 |
| 4 | 25 | 0 | 4.00 | 0.1000 |
(4)该小组同学对实验 1 和实验 3 分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第 1 次 | 第 2 次 | 第 3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 2 | 6.5 | 6.7 | 6.8 |
越快”的结论.甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到 了 错 误 的 实 验 结 论,甲 同 学 改 进 了 实 验 方 案,请 简 述 甲 同 学 改 进.
(5)该实验中使用的催化剂应选择 MnSO4并非 MnCl2,原因可用离子方程式表示为 2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
III.工业上可用软锰矿(主要成分为 MnO2)经下列生产过程制备高锰酸钾.
①由软锰矿提取得到 MnO2,然后在 MnO2、KOH 的熔融混合物中通入空气可制得锰酸钾(K2MnO4);
②向锰酸钾溶液中通入 CO2 可获得高锰酸钾.
(6)第①步生产过程中,在熔融混合物中通入空气时发生反应的化学方程式:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(7)向锰酸钾溶液中通入CO2可获得高锰酸该反应中氧化产物与还原产物的物质的量之比为2:1.
9.现有部分短周期元素的性质或原子结构如表:
(1)元素X在元素周期表中的位置第三周期ⅥA族;
(2)元素Z的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键和共价键;
(3)元素X与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是de;
a.常温下X的单质和T的单质状态不同
b.X的氢化物比T的氢化物稳定
c.X的单质与H2化合比T的单质与H2化合更容易
d.T的单质可以把X单质从它的氢化物中置换出来
e.X的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性弱
(4)写出T的单质与元素Y的最高价氧化物所对应的水化物反应的离子方程式2OH-+Cl2=Cl-+ClO-+H2O.
| 元素编号 | 元素性质或原子结构 |
| X | M层的电子数为K层电子数的3倍 |
| Y | 短周期中最活泼的金属元素 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 元素最高正价是+7价 |
(2)元素Z的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键和共价键;
(3)元素X与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是de;
a.常温下X的单质和T的单质状态不同
b.X的氢化物比T的氢化物稳定
c.X的单质与H2化合比T的单质与H2化合更容易
d.T的单质可以把X单质从它的氢化物中置换出来
e.X的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性弱
(4)写出T的单质与元素Y的最高价氧化物所对应的水化物反应的离子方程式2OH-+Cl2=Cl-+ClO-+H2O.
6.X、Y、Z、W为原子序数依次递增的短周期主族元素,X、Y两元素的原子最外层电子数之和为10,且X、Y可形成两种气态化合物甲和乙;Y、Z能形成一种具有强氧化性的淡黄色固体化合物丙;W与X位于同一主族.下列说法正确的是( )
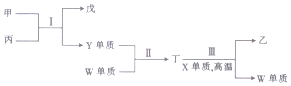

| A. | 原子半径:X<Y<Z | |
| B. | 反应Ⅰ中丙既能做氧化剂又作还原剂 | |
| C. | 非金属性:X>Y>W | |
| D. | 反应Ⅱ和Ⅲ反应均属于置换反应 |
7.下列各组物质性质的比较中正确的是( )
| A. | 酸性:H3PO4>H2SO4>HClO4 | B. | 碱性:Mg(OH)2>Ca(OH)2>KOH | ||
| C. | 热稳定性:H2S>H2O>HF | D. | 氧化性:F2>Cl2>Br2>I2 |
 2NO+O2在恒容的密闭容器中进行,达到平衡状态的标志是( )
2NO+O2在恒容的密闭容器中进行,达到平衡状态的标志是( )