题目内容
17.根据图所示的信息,判断下列叙述不正确的是( )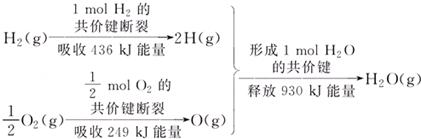
| A. | 1 mol H2的共价键形成放出436 kJ能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2(g)跟0.5mol O2(g)反应生成1 mol H2O(g)释放能量245 KJ | |
| D. | 1 mol H2(g)与0.5mol O2(g)的总能量大于1 mol H2O(g)的能量 |
分析 化学反应中断裂化学键吸收能量,形成化学键放出能量,由题给数据可知1 mol H2(g)跟0.5mol O2(g)反应,吸收能量为436kJ+249kJ=685kJ,生成1mol水放出930kJ,则反应为放热反应,反应物总能量大于生成物总能量,以此解答该题.
解答 解:A.1mol氢气的共价键断裂放出的能量和形成1mol氢气的共价键吸收的能量相同,故A正确;
B.由题给数据可知1 mol H2(g)跟0.5mol O2(g)反应,吸收能量为436kJ+249kJ=685kJ,生成1mol水放出930kJ,则反应为放热反应,故B错误;
C.吸收能量为436kJ+249kJ=685kJ,生成1mol水放出930kJ,释放能量245kJ,故C正确;
D.反应为放热反应,反应物总能量大于生成物总能量,故D正确.
故选B.
点评 本题考查化学反应与能量的变化,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握反应热的计算方法,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
1.下列反应中,水只作氧化剂的是( )
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | 2H2O $\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2↑ |
2.对下列实验过程的评价,正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定会有CO32- | |
| B. | 某溶液中滴加了Na2CO3溶液,生成白色沉淀,该溶液中一定会有Ba2+ | |
| C. | 某无色溶液滴加酚酞试液显红色,该溶液不一定是碱液 | |
| D. | 验证烧碱溶液中是否含Cl-,先加稀HCl除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
5.在一定温度下,向2L的密闭容器中加入1molHI,发生反应2HI(g)?H2(g)+I2(g)△H>0,2min后反应达到平衡,测得H2的物质的量为0.1mol,下列说法正确的是( )
| A. | 该温度下,反应的平衡常数是$\frac{1}{64}$ | |
| B. | 0~2min内,HI的平均反应速率为0.1mol•L-1•min-1 | |
| C. | 在恒容条件下,向该体系中充入HI气体,平衡不移动,反应速率不变 | |
| D. | 升高温度,平衡向正反应方向移动,只有正反应速率加快 |
2.废电池必须集中处理的主要原因是( )
| A. | 防止电池中汞、镉、铬、铅等重金属元素对土壤和水源的污染 | |
| B. | 回收其中的石墨电极 | |
| C. | 不使电池渗泄的电解液腐蚀其他物品 | |
| D. | 回收其中的各种金属及塑料包装等 |
9.1918年,德国化学家弗里茨•哈伯因为发明合成氨方法而获得诺贝尔化学奖.1931年,卡尔•博施因为改进合成氨方法获得诺贝尔化学奖.2007年10月诺贝尔化学奖授予了德国化学家格哈德•埃特尔,理由是他发现了哈伯一博施法合成氨的作用机理.现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
| A. | 达到化学平衡时,将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应速率和逆反应速率都为零 |
7.浓硝酸不具有的性质是( )
| A. | 不稳定性 | B. | 可溶解水晶 | C. | 强氧化性 | D. | 易挥发性 |