题目内容
2.对下列实验过程的评价,正确的是( )| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定会有CO32- | |
| B. | 某溶液中滴加了Na2CO3溶液,生成白色沉淀,该溶液中一定会有Ba2+ | |
| C. | 某无色溶液滴加酚酞试液显红色,该溶液不一定是碱液 | |
| D. | 验证烧碱溶液中是否含Cl-,先加稀HCl除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
分析 A.无色气体可能为二氧化碳或二氧化硫;
B.白色沉淀可能为碳酸钡或碳酸钙等;
C.滴加酚酞试液显红色,溶液显碱性;
D.验证烧碱溶液中是否含Cl-,先加稀HCl除去OH-,且加盐酸引入氯离子,干扰检验.
解答 解:A.无色气体可能为二氧化碳或二氧化硫,则固体中含CO32-或HCO3-,或SO32-等,故A错误;
B.白色沉淀可能为碳酸钡或碳酸钙等,则溶液中可能会有Ba2+或Ca2+等,故B错误;
C.滴加酚酞试液显红色,溶液显碱性,则为碱或盐溶液,如NaOH、碳酸钠等,故C正确;
D.验证烧碱溶液中是否含Cl-,先加稀HCl除去OH-,且加盐酸引入氯离子,干扰检验,应先加稀硝酸、再加硝酸银检验,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握常见离子的检验、现象与结论及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
13.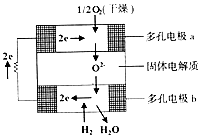 固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
 固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | O2-向电池的正极移动 | |
| B. | 有H2放电的b极为电池的正极 | |
| C. | a极对应的电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该电池的总反应方程式为2H2+O2=2H2O |
10.下列各组离子,能在指定溶液中大量共存的是( )
| A. | 使pH试纸变深蓝色的溶液中:K+、CO32-、Na+、AlO2- | |
| B. | 1.0mol/LKNO3溶液:H+、Fe2+、Cl-、SO42- | |
| C. | 与铝反应产生H2的溶液中:Na+、Mg2+、HCO3-、SO42- | |
| D. | 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、I- |
17.下列实验操作的描述中,正确的是( )
| A. | 取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 用溶解、过滤的方法分离氯化钠和硝酸钾的混合物 | |
| C. | 称量NaOH固体,先在天平两盘上放大小相等纸片,然后NaOH放在左盘纸片上称量 | |
| D. | 利用丁达尔效应可以区别溶液和胶体 |
7.常温下,某溶液中水电离出的H+浓度为1×10-13mol•L-1,有关该溶液的说法正确的是( )
| A. | 加入铝粉一定能产生大量H2 | |
| B. | 溶液中OH-的浓度一定为0.1mol•L-1 | |
| C. | 还可能大量存在Na+、NH4+‘Cl-、S2O32- | |
| D. | 通入少量 HCl 气体可能会使溶液中水的电离程度增大 |
14.下列说法正确的是( )
| A. | 锌锰电池和碱性锌锰电池的正极材料均是锌 | |
| B. | 锌锰电池中电解质主要是NH4Cl,而碱性锌锰电池中的电解质主要是KOH | |
| C. | 碱性锌锰电池不如锌锰电池的寿命长 | |
| D. | 干电池放电之后还可再充电 |
17.根据图所示的信息,判断下列叙述不正确的是( )
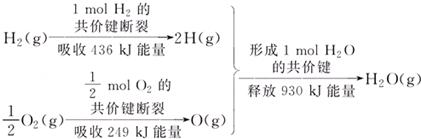

| A. | 1 mol H2的共价键形成放出436 kJ能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2(g)跟0.5mol O2(g)反应生成1 mol H2O(g)释放能量245 KJ | |
| D. | 1 mol H2(g)与0.5mol O2(g)的总能量大于1 mol H2O(g)的能量 |