题目内容
9.1918年,德国化学家弗里茨•哈伯因为发明合成氨方法而获得诺贝尔化学奖.1931年,卡尔•博施因为改进合成氨方法获得诺贝尔化学奖.2007年10月诺贝尔化学奖授予了德国化学家格哈德•埃特尔,理由是他发现了哈伯一博施法合成氨的作用机理.现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )| A. | 达到化学平衡时,将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应速率和逆反应速率都为零 |
分析 可逆反应反应物不能完全反应,达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.
解答 解:A.该反应是可逆反应,N2不可能完全转化为NH3,故A错误;
B.达到平衡时,N2、H2、NH3的物质的量浓度不再发生变化而不是一定相等,反应平衡时各物质的浓度是否相等取决于起始时各物质的量的关系和转化的程度,N2、H2按1:3混合,化学计量数为1:3,所以转化率相等,平衡时,N2、H2的物质的量浓度一定为1:3,故B错误;
C.随反应进行,N2、H2和NH3的物质的量浓度发生变化,N2、H2和NH3的物质的量浓度不再变化,说明到达平衡状态,故C正确;
D.可逆反应时动态平衡,达到化学平衡时,正反应和逆反应的速率相同但不为零,故D错误;
故选C.
点评 本题考查平衡状态的判断,选择判断的标准应随反应进行变化,当该标准不再变化说明到达平衡状态,题目难度中等.

练习册系列答案
相关题目
13.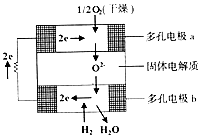 固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
 固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | O2-向电池的正极移动 | |
| B. | 有H2放电的b极为电池的正极 | |
| C. | a极对应的电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该电池的总反应方程式为2H2+O2=2H2O |
14.下列说法正确的是( )
| A. | 锌锰电池和碱性锌锰电池的正极材料均是锌 | |
| B. | 锌锰电池中电解质主要是NH4Cl,而碱性锌锰电池中的电解质主要是KOH | |
| C. | 碱性锌锰电池不如锌锰电池的寿命长 | |
| D. | 干电池放电之后还可再充电 |
17.根据图所示的信息,判断下列叙述不正确的是( )
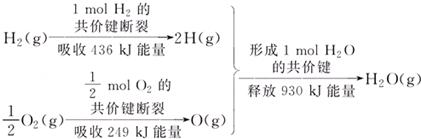

| A. | 1 mol H2的共价键形成放出436 kJ能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2(g)跟0.5mol O2(g)反应生成1 mol H2O(g)释放能量245 KJ | |
| D. | 1 mol H2(g)与0.5mol O2(g)的总能量大于1 mol H2O(g)的能量 |
4.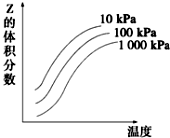 图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )
图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )
 图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )
图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )| A. | 上述可逆反应的正反应为放热反应 | B. | X、Y、Z均为气态 | ||
| C. | 增大压强平衡向正反应方向移动 | D. | 上述反应的逆反应的△H<0 |
1.下列有关化学用语表示正确的是( )
| A. | 重氢原子:${\;}_{1}^{2}$D | |
| B. | S2-的结构示意图: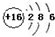 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | N2的电子式: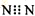 |
19.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 天然气、太阳能、生物质能、风能、氢能均属于新能源 | |
| C. | 自发反应的熵一定增大,非自发反应的熵一定减小 | |
| D. | 常温下,反应C(s)+CO2(g)?2CO(g)不能自发进行,则该反应的△H>0 |
