题目内容
硼酸是硼的氢氧化物,已知其结构为平面三角形结构.
(1)画出硼酸的结构图式: ;
(2)硼酸为无色晶体,可溶于水,水溶液显弱酸性.已知硼酸本身不能电离出H+,它的电离必须有H2O参加,电离后形成正四面体形的硼酸根离子,试写出硼酸电离的方程式(以结构式表示) .
(1)画出硼酸的结构图式:
(2)硼酸为无色晶体,可溶于水,水溶液显弱酸性.已知硼酸本身不能电离出H+,它的电离必须有H2O参加,电离后形成正四面体形的硼酸根离子,试写出硼酸电离的方程式(以结构式表示)
考点:弱电解质在水溶液中的电离平衡,结构式
专题:
分析:(1)硼酸是硼的氢氧化物,B最外层只有3个电子,硼酸结构为平面三角形结构,则B原子价层电子对个数是3且不含孤电子对,所以B和O之间共用一对电子,据此书写其结构式;
(2)硼酸的水溶液呈酸性,硼酸本身不能电离出H+,由硼酸的电子式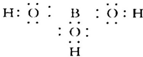 ,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,能与H2O电离出的OH-结合形成配位键,据此分析解答.
,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,能与H2O电离出的OH-结合形成配位键,据此分析解答.
(2)硼酸的水溶液呈酸性,硼酸本身不能电离出H+,由硼酸的电子式
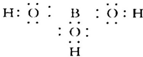 ,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,能与H2O电离出的OH-结合形成配位键,据此分析解答.
,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,能与H2O电离出的OH-结合形成配位键,据此分析解答.解答:
解:(1)硼酸是硼的氢氧化物,B最外层只有3个电子,硼酸结构为平面三角形结构,则B原子价层电子对个数是3且不含孤电子对,所以B和O之间共用一对电子,则硼酸结构式为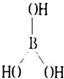 ,
,
故答案为: ;
;
(2)硼酸的水溶液呈酸性,硼酸本身不能电离出H+,由硼酸的电子式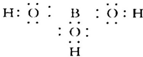 ,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,所以能与H2O电离出的OH-结合形成配位键,从而破坏了水的电离平衡,使c(H+)>c(OH-)因而溶液呈酸性,电离方程式为
,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,所以能与H2O电离出的OH-结合形成配位键,从而破坏了水的电离平衡,使c(H+)>c(OH-)因而溶液呈酸性,电离方程式为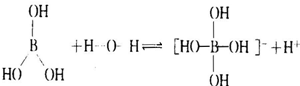 ,
,
故答案为: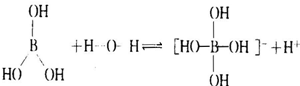 .
.
 ,
,故答案为:
 ;
;(2)硼酸的水溶液呈酸性,硼酸本身不能电离出H+,由硼酸的电子式
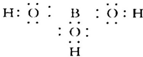 ,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,所以能与H2O电离出的OH-结合形成配位键,从而破坏了水的电离平衡,使c(H+)>c(OH-)因而溶液呈酸性,电离方程式为
,可知B原子最外层未达8个电子稳定结构,B原子具有空轨道,能结合含有孤电子对的原子形成配位键,所以能与H2O电离出的OH-结合形成配位键,从而破坏了水的电离平衡,使c(H+)>c(OH-)因而溶液呈酸性,电离方程式为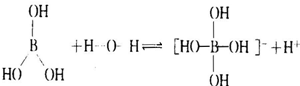 ,
,故答案为:
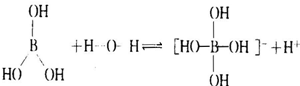 .
.
点评:本题考查弱电解质的电离、分子结构式的书写,侧重考查学生获取信息、运用信息解答问题能力,会根据微粒空间构型结合中心原子最外层电子数确定结构式,知道配位键的形成条件,题目难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
NA为阿伏加德罗常数,关于a g亚硫酸钠晶体(Na2SO3?7H2O)的说法中正确的是( )
A、含Na+数目为
| ||
B、含氧原子数目为
| ||
C、完全氧化SO32-时转移电子数目为
| ||
D、含结晶水分子数目为
|
根据下列标准,分类合理的是( )
| A、根据物质的组成元素是否单一,将纯净物分为单质和化合物 |
| B、根据电解质溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
| C、根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D、根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应 |
下列反应的离子方程式正确的是( )
| A、向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | ||
| B、向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | ||
C、Ba(OH)2溶液加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO
| ||
| D、向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH-+Ca2+═MgCO3↓+CaCO3↓+2H2O |
X、Y都是短周期元素,X原子最外层只有一个电子,Y元素最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是( )
| A、R一定是共价化合物 |
| B、R一定是离子化合物 |
| C、R可能是共价化合物,也可能是离子化合物 |
| D、R可能是气态物质,也可能是固态物质 |
下列各组不能发生离子反应的是( )
| A、硫酸与氯化铜溶液 |
| B、氢氧化钠溶液与氯化亚铁溶液 |
| C、碳酸钠溶液与稀硝酸 |
| D、澄清石灰水与稀盐酸 |
 金属及其化合物在国民经济发展中起着重要作用
金属及其化合物在国民经济发展中起着重要作用