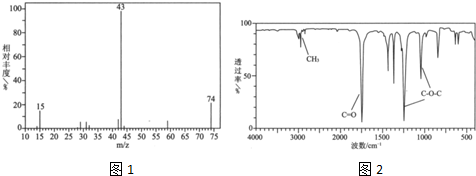
题目内容
钠、铁两种金属单质及其化合物在生产、生活中有着广泛的应用.请回答:
(1)两种金属中,能与冷水发生剧烈反应的是 ,由此说明,钠的金属性比铁 (填“强”或“弱”).
(2)某些补铁剂的成分中含有硫酸亚铁,长期放置会因氧化而变质.检验硫酸亚铁是否变质的试剂是 (填序号).
①稀盐酸 ②石蕊溶液 ③KSCN溶液
(3)向硫酸亚铁溶液中滴入氢氧化钠溶液,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色,此过程中涉及的氧化还原反应的化学方程式为 .
(1)两种金属中,能与冷水发生剧烈反应的是
(2)某些补铁剂的成分中含有硫酸亚铁,长期放置会因氧化而变质.检验硫酸亚铁是否变质的试剂是
①稀盐酸 ②石蕊溶液 ③KSCN溶液
(3)向硫酸亚铁溶液中滴入氢氧化钠溶液,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色,此过程中涉及的氧化还原反应的化学方程式为
考点:钠的化学性质,铁的化学性质,二价Fe离子和三价Fe离子的检验
专题:元素及其化合物
分析:(1)钠能够与冷水反应,铁能够与水蒸气在高温条件下反应;金属与水或者与酸反应置换氢气越容易金属性越强;
(2)二价铁离子易被氧化为三价铁离子,三价铁遇到KSCN溶液显血红色;
(3)氢氧化亚铁具有还原性,在空气中被氧化生成氢氧化铁.
(2)二价铁离子易被氧化为三价铁离子,三价铁遇到KSCN溶液显血红色;
(3)氢氧化亚铁具有还原性,在空气中被氧化生成氢氧化铁.
解答:
解:(1)钠能够与冷水反应,铁能够与水蒸气在高温条件下反应;钠比铁与水反应置换氢气更容易,金属与水或者与酸反应置换氢气越容易金属性越强,所以金属性钠强于铁;
故答案为:钠、强;
(2)硫酸亚铁,长期放置会因氧化生成硫酸铁,三价铁遇到KSCN溶液显血红色,常用KSCN溶液检验三价铁离子的存在,
故选:③;
(3)氢氧化亚铁具有还原性,在空气中被氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:钠、强;
(2)硫酸亚铁,长期放置会因氧化生成硫酸铁,三价铁遇到KSCN溶液显血红色,常用KSCN溶液检验三价铁离子的存在,
故选:③;
(3)氢氧化亚铁具有还原性,在空气中被氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查了钠、铁极其化合物的性质,属于对基础知识的考查,明确物质的性质是解题关键,注意二价铁离子与三价铁离子的检验.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
| A、含有NA个氢原子的氢气在标准状况下的体积约为11.2L |
| B、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
| C、在常温常压下,35.5g Cl2含有的分子数为0.5NA |
| D、标准状况下,11.2L H2O含有的分子数为0.5NA |
 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇.