题目内容
6.加热13.7g Na2CO3和NaHCO3的固体混合物至质量不再发生变化,剩余固体质量为10.6g,则混合物中Na2CO3的质量分数约为( )| A. | 84% | B. | 50% | C. | 16% | D. | 39% |
分析 加热时NaHCO3分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,固体质量的变化是NaHCO3分解的缘故,可结合方程式用差量法计算出碳酸氢钠的质量,再计算出碳酸钠的质量及质量分数.
解答 解:设混合物中含有xgNaHCO3,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
168 62
xg 13.7g-10.6g=3.1g
则:x=$\frac{168×3.1g}{62}$=8.4g,
所以:m(Na2CO3)=13.7g-8.4g=5.3g,
则混合物中Na2CO3的质量分数为:w(Na2CO3)=$\frac{5.3g}{13.7g}$=39%,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握差量法在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
14.设阿伏加德罗常数的数值为NA,下列叙述正确的是( )
| A. | 0.5 mol•L-1 NaOH溶液中Na+数为0.5NA | |
| B. | 标准状况下,22.4 L四氯化碳含有的分子数为NA | |
| C. | 常温常压下,1mol Na2O2与足量CO2反应,电子转移数为NA | |
| D. | 标准状况下,16 g氧气臭氧的混合气体所含原子数一定为2NA |
11. 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol•L-1硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol•L-1NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后,测量混合液温度.请回答:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒;
(2)NaOH溶液稍过量的原因确保硫酸被完全中和;
(3)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是用套在温度计上的环形玻璃搅拌棒轻轻地搅动;
(5)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.68kJ/mol;
(6)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)不能(填“能”或“不能”)用Ba(OH)2代替氢氧化钠溶液和稀硫酸反应;若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于(填“小于”、“等于”或“大于”)57.3kJ.原因是浓硫酸稀释放热.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol•L-1硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol•L-1NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后,测量混合液温度.请回答:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒;
(2)NaOH溶液稍过量的原因确保硫酸被完全中和;
(3)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是用套在温度计上的环形玻璃搅拌棒轻轻地搅动;
(5)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.68kJ/mol;
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | | |
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)不能(填“能”或“不能”)用Ba(OH)2代替氢氧化钠溶液和稀硫酸反应;若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于(填“小于”、“等于”或“大于”)57.3kJ.原因是浓硫酸稀释放热.
15.下列反应的离子方程式书写正确的是( )
| A. | 用氢氧化钠溶液中和稀硝酸:H++OH-═H2O | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 铜与硝酸银溶液的反应:Cu+Ag+═Cu2++Ag |
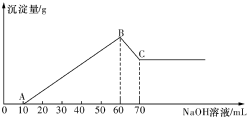 有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子.现分别取溶液进行下列实验:
有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子.现分别取溶液进行下列实验:
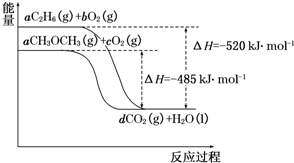 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.如图是乙烷(C2H6)、二甲醚(CH3OCH3)燃烧过程的能量变化图.请回答下列问题:
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.如图是乙烷(C2H6)、二甲醚(CH3OCH3)燃烧过程的能量变化图.请回答下列问题: