题目内容
12. 有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子.现分别取溶液进行下列实验:
有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子.现分别取溶液进行下列实验:(1)加入淀粉溶液,未见蓝色.
(2)加入少量AgNO3溶液有黄色沉淀和气体生成.
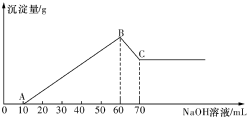
(3)逐滴加入1mol•L-1NaOH溶液,随着NaOH溶液的滴人,产生沉淀的量如图所示.
试确定:溶液中一定不存在的离子有NH4+、Fe3+、CO32-,其中阴离子物质的量为0.06mol,加入少量AgNO3溶液的离子反应方程式为8I-+2Ag++8H++2NO3-=2AgI+2NO↑+3I2+4H2O.
分析 向溶液中加入NaOH溶液,开始没有沉淀生成,而后有产生沉淀,说明溶液中H+,因此溶液显酸性,则CO32-不能存在,溶液中加入少量AgNO3溶液有黄色沉淀和气体生成,说明溶液中含有I-,结合溶液加入淀粉溶液未见蓝色,说明没有Fe3+,加入足量的氢氧化钠,最终沉淀部分溶解,则溶液中一定含有Mg2+、Al3+,又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀质量立即减小,说明溶液中不存在NH4+,结合图象中各阶段消耗的氢氧化钠,计算溶液中n(H+)、n(Mg2+)、n(Al3+),根据电荷守恒计算n(I-)=n(H+)+2n(Mg2+)+3n(Al3+);
原溶液加入硝酸银溶液时,会生成AgI沉淀,酸性条件下硝酸根具有强氧化性,可以氧化碘离子为碘单质,同时被还原为NO.
解答 解:向溶液中加入NaOH溶液,开始没有沉淀生成,而后有产生沉淀,说明溶液中H+,因此溶液显酸性,则CO32-不能存在,溶液中加入少量AgNO3溶液有黄色沉淀和气体生成,说明溶液中含有I-,结合溶液加入淀粉溶液未见蓝色,说明没有Fe3+,加入足量的氢氧化钠,最终沉淀部分溶解,则溶液中一定含有Mg2+、Al3+,又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀质量立即减小,说明溶液中不存在NH4+,故溶液中一定没有:NH4+、Fe3+、CO32-;
由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.01L×1mol/L=0.01mol,则n(H+)=0.01mol;
最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠(0.07-0.06)L×1mol/L=0.01mol,则n[Al(OH)3]=0.01mol,根据铝元素守恒可知n(Al3+)=0.01mol;
第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为(0.06-0.01)L×1mol/L=0.05mol,则n(Mg2+)=(0.05mol-0.01mol×3)÷2=0.01mol,
根据电荷守恒溶液中n(I-)=n(H+)+2n(Mg2+)+3n(Al3+)=0.01mol+0.01mol×2+0.01mol×3=0.06mol;
原溶液加入硝酸银溶液时,会生成AgI沉淀,酸性条件下硝酸根具有强氧化性,可以氧化碘离子为碘单质,同时被还原为NO,反应离子方程式为:8I-+2Ag++8H++2NO3-=2AgI+2NO↑+3I2+4H2O,
故答案为:NH4+、Fe3+、CO32-;0.06mol;8I-+2Ag++8H++2NO3-=2AgI+2NO↑+3I2+4H2O.
点评 本题考查离子共存、反应图象识别以及离子反应有关计算等,是对学生的综合能力的考查,较好的考查学生元素化合物知识、分析解决问题的能力,难度较大.

| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3?↑+CO32-+2H2O | |
| C. | 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| A. | 硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+═S↓+SO2↑+H2O | |
| B. | 向CuSO4溶液中通入H2S气体:Cu2++S2-═CuS↓ | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl- | |
| D. | 重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O═2H++2CrO42-(黄色) |
工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
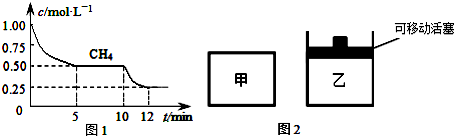
①在一个密闭容器中进行上述反应,测得CH4的物质的量浓度随反应时间的变化如下图1所示,10min时,改变的外界条件可能是升高温度等.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4)
(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c 均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
③在一定温度下,在一个容积不变的密闭容器中,发生合成氨反应,下列能判断该反应达到化学平衡状态的是cd
a.v(N2)=3v(NH3) b.混合气体的密度不随时间改变
c.混合气体的平均相对分子质量不随时间改变 d.容器中的压强不随时间改变
e.c(N2)=c(NH3)
| A. | 3H2S+2NO3-+2H+═2NO↑+3S↓+4H2O | |
| B. | 3Fe3++3NO3-+6H2S═3NO↑+6S↓+3Fe2++6H2O | |
| C. | Fe3++3NO3-+5H2S+2H+═3NO↑+5S↓+Fe2++6H2O | |
| D. | Fe3++9NO3-+14H2S+8H+═9NO↑+14S↓+Fe2++18H2O |
| A. | 氧化剂的作用 | B. | 还原剂的作用 | C. | 催化剂的作用 | D. | 吸附剂的作用 |
| A. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| B. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 将稀硫酸滴入氢氧化钡溶液中:Ba2++SO42-═BaSO4↓ |
| A. | 金属钠在用小刀切割后,剩余的钠应放回煤油中 | |
| B. | 焰色反应实验前,铂丝应先用盐酸洗涤后灼烧至无色,焰色反应是一种物理变化 | |
| C. | 实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管伸入液面下 | |
| D. | 将烧碱溶液保存在磨口的细口玻璃瓶中 |
| A. | 84% | B. | 50% | C. | 16% | D. | 39% |