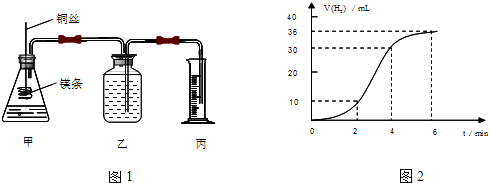
题目内容
1.某学生欲用电解纯净CuSO4 溶液的方法来测定铜的相对原子质量.其实验过程如图1所示: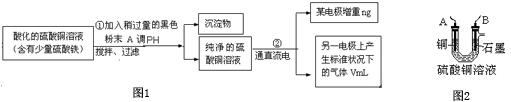
(1)步骤①所加的A的化学式为CuO;已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,则加入A调PH范围是3.3<pH≤4 (已知lg2=0.3)
(2)步骤②中所用的部分仪器如图2:则A应接在直流电源的负极(填“正”或“负”).
(3)石墨电极上的电极反应式4OH--4e-=2H2O+O2↑.
(4)下列实验操作中必要的是(填字母)ABDE.
A.称量电解前电极的质量
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗
C.刮下电解后电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干→称重→再烘干→再称重”进行
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为$\frac{11200n}{V}$(用带有n、V的计算式表示).
(6)若②用甲醇-O2-熔融碳酸盐电池提供电能,写出该电池负极的电极反应式CH3OH-6e-+3CO32-═4CO2+2H2O.
分析 (1)pH为4~5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解,加入稍过量的CuO,可以得到纯净的硫酸铜溶液,故加入CuO调节pH值,Fe3+完全水解形成Fe(OH)3沉淀而除去;加入A调PH范围应确保Fe3+沉淀完全,而Cu2+不沉淀,据此计算pH;
(2)由于电解硫酸铜溶液时,要求一电极增重,另一电极有气体生成,故A应做阴极,B做阳极,据此分析;
(3)石墨电极上氢氧根放电;
(4)需要准确称量生成铜的质量,铜电极前后质量之差为生成的Cu的质量,Cu电解表面会附着离子,应清洗除去,由于铜与氧气发生反应,在空气存在情况下,应低温烘干,称量两次之差小于天平的感量,说明烘干;
(5)根据电子转移守恒计算Cu的相对原子质量;
(6)甲醇-O2-熔融碳酸盐电池中,负极上甲醇放电生成二氧化碳,据此分析电极反应.
解答 解:(1)pH为4~5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解,加入稍过量的CuO,可以得到纯净的硫酸铜溶液,故加入CuO通过消耗H+而调整溶液的pH使之升高,使Fe3+完全水解形成Fe(OH)3沉淀而除去;加入A调PH范围应确保Fe3+沉淀完全,由于当Fe3+沉淀完全时,即溶液中Fe3+的浓度小于1×10-5 mol•L-1,故有:c(Fe3+)×c3(OH-)=8.0×10-38,解得c(OH-)>2×10-11mol/L,c(H+)<5×10-4mol/L,则pH>3.3;但Cu2+不能沉淀,故有:c(Cu2+)×c2(OH-)=3.0×10-20,而c(Cu2+)=3mol/L,解得c(OH-)≤10-10mol/L,c(H+)≥10-4mol/L,则pH≤4.即应调节溶液的pH为3.3<pH≤4.
故答案为:CuO;3.3<pH≤4;
(2)由于电解硫酸铜溶液时,要求一电极增重,另一电极有气体生成,故A应做阴极,电极反应为:Cu2++2e-=Cu,B做阳极,电极反应为:4OH--4e-+2H2O=4OH-,故A应连
电源的负极,故答案为:负;
(3)石墨为阳极,氢氧根放电,故电极反应为:4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(4)需要准确称量生成铜的质量,铜电极前后质量之差为生成的Cu的质量,Cu电解表面会附着离子,应清洗除去,由于铜与氧气发生反应,在空气存在情况下,应低温烘干,称量两次之差小于天平的感量,说明烘干,故需要进行ABDE操作,不需要进行C操作,
故答案为:A、B、D、E;
(5)VmL氧气的物质的量为$\frac{V×1{0}^{-3}L}{22.4L/mol}$=$\frac{V}{22400}$mol,设Cu的相对原子质量为Mr,根据电子转移守恒,则:$\frac{n}{{M}_{r}}$×2=$\frac{V}{22400}$mol×4,解得Mr=$\frac{11200n}{V}$,
故答案为:$\frac{11200n}{V}$;
(6)甲醇-O2-熔融碳酸盐电池中,负极上甲醇放电生成二氧化碳,电极反应式为:CH3OH-6e-+3CO32-═4CO2+2H2O,故答案为:CH3OH-6e-+3CO32-═4CO2+2H2O.
点评 本题以测定Cu的相对原子质量为载体,考查电解原理、对工艺流程的理解、常用化学用语、化学计算等,难度中等,理解工艺流程是解题的关键,需要学生具有扎实的基础与综合运用知识分析、解决问题的能力.

| A. | 3H2S+2NO3-+2H+═2NO↑+3S↓+4H2O | |
| B. | 3Fe3++3NO3-+6H2S═3NO↑+6S↓+3Fe2++6H2O | |
| C. | Fe3++3NO3-+5H2S+2H+═3NO↑+5S↓+Fe2++6H2O | |
| D. | Fe3++9NO3-+14H2S+8H+═9NO↑+14S↓+Fe2++18H2O |
(1)基态Al原子中,电子填充的最高能级是3p,基态Cr原子的价电子排布式是3d54s1.
(2)用“>”或“<”填空:
| 第一电离能 | 键能 | 沸点 | 离子半径 |
| Be>B | C-C>Si-Si | H2S<H2O | Al3+<O2- |
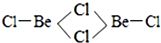
(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式SiH4+2O2=SiO2+2H2O.
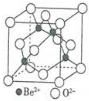
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg•cm-3,则晶胞连长为$\root{3}{\frac{100}{ρ{N}_{A}}}$cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示).
| A. | 84% | B. | 50% | C. | 16% | D. | 39% |
| A. | Mg、Al | B. | Mg、Fe | C. | Zn、Fe | D. | Al、Zn |
| A. | 凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型 | |
| B. | 在SCl2中,中心原子S采取sp杂化轨道成键 | |
| C. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| D. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |