题目内容
16.某烧碱样品中含有少量不与酸作用的可溶性杂质,现用中和滴定法测定该烧碱的纯度,请根据实验回答:(1)将称量好的9.0g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除500mL容量瓶、量筒、烧杯、玻璃棒外,还有一种必须使用的仪器是胶头滴管;
(2)用碱式滴定管量取15.00mL待测液于锥形瓶中,滴入几滴酚酞;
(3)用0.3000mol•L-1的标准盐酸滴定待测液,判断确定终点的现象是当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色;
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系不可能出现的是AD.
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)
分析 (1)配制500mL一定物质的量浓度的溶液所需主要仪器是500mL容量瓶、量筒、烧杯、玻璃棒、胶头滴管;
(2)量取15.00mL待测的碱性溶液应选用碱式滴定管;
(3)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)滴定过程中溶液从碱性溶液向中性过渡,溶液里的溶质从NaOH到NaCl、NaOH过渡,最后呈中性是溶质为NaCl,但溶液始终显中性,存在电荷守恒式:c(Na+)+c(H+)=c(OH-)+c(Cl-),据此分析判断.
解答 解:(1)配制500mL溶液需要的主要仪器除500mL容量瓶、量筒、烧杯、玻璃棒外,还有一种必须使用的仪器是定容时要用的胶头滴管,故答案为:胶头滴管;
(2)为精确量取15.00mL待测碱性溶液于锥形瓶中,需要使用碱式滴定管,故答案为:碱式滴定管;
(3)滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,故答案为:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色;
(4)A.若c(Na+)>c(Cl-)>c(H+)>c(OH-)成立,则c(Na+)+c(H+)>c(Cl-)+c(OH-),明显与溶液里存在的电荷守恒式不吻合,故A错误;
B.在NaOH溶液只滴加几滴稀盐酸,此时溶液只生成少量NaCl,应该存在c(Na+)>c(OH-)>c(Cl-)>c(H+),故B正确;
C.溶液始终显中性,存在电荷守恒式c(Na+)+c(H+)=c(OH-)+c(Cl-),故C正确;
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)与溶液里存在的电荷式c(Na+)+c(H+)=c(OH-)+c(Cl-)不符,故D错误;
故选AD.
点评 本题主要考查了酸碱中和滴定实验操作以及滴定过程中溶液里离子浓度大小比较,难度不大,能准确写出溶液里的电荷守恒式是解答关键,结合所学知识即可完成.

 天天练口算系列答案
天天练口算系列答案| A. | 84% | B. | 50% | C. | 16% | D. | 39% |
| 编号 | 物质 | 试剂或操作名称 |
| ① | 除杂质:NaHCO3溶液(Na2CO3) | |
| ② | 除杂质:MgO(Al2O3) | |
| ③ | 除杂质:FeCl2溶液(FeCl3) | |
| ④ | 鉴别:NaCl、KCl | |
| ⑤ | 鉴别:AlCl3、Al2(SO4)3溶液 |
| A. | 分子式为C7H8O,且含苯环的有机化合物有4种 | |
| B. | 乙醇能使酸性高锰酸钾溶液褪色 | |
| C. | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的使酸性KMnO4溶液褪色的气体只是乙烯 | |
| D. | 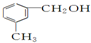 遇FeCl3溶液可显紫色 遇FeCl3溶液可显紫色 |
| A. | 凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型 | |
| B. | 在SCl2中,中心原子S采取sp杂化轨道成键 | |
| C. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| D. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
| A. | 氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 25℃时,pH=12的NaOH溶液与pH=12的氨水:c (Na+)=c(NH4+ ) | |
| C. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(OH-)=c(HCO3-)+c( H+) |
| A. | 一定存在的离子为Fe3+、SO42- | |
| B. | 一定不存在的离子为CO32-、I- | |
| C. | 不能确定的离子为K+、SO42- | |
| D. | 确定是否含有K+离子需要经过焰色反应 |
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 任何反应中的能量变化都表现为热量变化 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 所有化学反应都可以设计成原电池 |