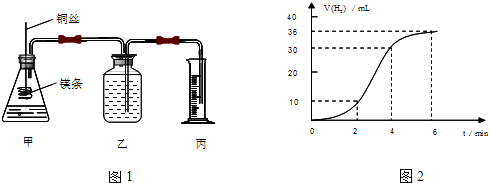
题目内容
13.过硫酸钠在酸性环境下,在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,所得溶液加入BaCl2可以产生白色沉淀,该反应的离子方程式为5S2O82-+2Mn2++8H2O=$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+,该反应的氧化剂是S2O82-,氧化产物是MnO4-.分析 过硫酸钠(Na2S2O8)在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,则Mn2+被氧化为MnO4-,所得溶液加入BaCl2可以产生白色沉淀,说明S2O82-被还原为SO42-(S2O82-中过氧键具有强氧化性).
解答 解:过硫酸钠(Na2S2O8)在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,则Mn2+被氧化为MnO4-,所得溶液加入BaCl2可以产生白色沉淀,说明S2O82-被还原为SO42-(S2O82-中过氧键具有强氧化性),反应离子方程式为:5S2O82-+2Mn2++8H2O=$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+,氧化剂为,氧化产物为MnO4-,
故答案为:5S2O82-+2Mn2++8H2O=$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+;S2O82-;MnO4-.
点评 本题考查氧化还原反应及基本概念,题目中过硫酸钠中学没有涉及,注意S2O82-中过氧键具有强氧化性.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
3.下列指定反应的离子方程式正确的是( )
| A. | 硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+═S↓+SO2↑+H2O | |
| B. | 向CuSO4溶液中通入H2S气体:Cu2++S2-═CuS↓ | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl- | |
| D. | 重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O═2H++2CrO42-(黄色) |
4.下列离子方程式书写正确的是( )
| A. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| B. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 将稀硫酸滴入氢氧化钡溶液中:Ba2++SO42-═BaSO4↓ |
1.下列实验操作中,不正确的是( )
| A. | 金属钠在用小刀切割后,剩余的钠应放回煤油中 | |
| B. | 焰色反应实验前,铂丝应先用盐酸洗涤后灼烧至无色,焰色反应是一种物理变化 | |
| C. | 实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管伸入液面下 | |
| D. | 将烧碱溶液保存在磨口的细口玻璃瓶中 |
2.如图是侯氏制碱法在实验室进行模拟实验的生产流程示意图:
饱和食盐水$→_{Ⅰ}^{通入足量的气体A}$A和食盐饱和溶液$→_{Ⅱ}^{通入过量的气体B}$悬浊液$→_{Ⅲ}^{过滤}$晶体$\overrightarrow{Ⅳ}$纯碱
则下列叙述错误的是( )
饱和食盐水$→_{Ⅰ}^{通入足量的气体A}$A和食盐饱和溶液$→_{Ⅱ}^{通入过量的气体B}$悬浊液$→_{Ⅲ}^{过滤}$晶体$\overrightarrow{Ⅳ}$纯碱
则下列叙述错误的是( )
| A. | A气体是NH3,B气体是CO2 | |
| B. | 侯氏制碱法的工艺过程应用了物质溶解度的差异 | |
| C. | 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 | |
| D. | 第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶 |
6.加热13.7g Na2CO3和NaHCO3的固体混合物至质量不再发生变化,剩余固体质量为10.6g,则混合物中Na2CO3的质量分数约为( )
| A. | 84% | B. | 50% | C. | 16% | D. | 39% |
7.只用一种试剂或操作即可除去少量杂质或鉴别物质,将该试剂或操作名称填在空格处.
写出以上表格中对应的离子反应:①CO2+CO32-+H2O=2HCO3-;②Al2O3+2OH-=2AlO2-+H2O;③Fe+2Fe3+=3Fe2+.
| 编号 | 物质 | 试剂或操作名称 |
| ① | 除杂质:NaHCO3溶液(Na2CO3) | |
| ② | 除杂质:MgO(Al2O3) | |
| ③ | 除杂质:FeCl2溶液(FeCl3) | |
| ④ | 鉴别:NaCl、KCl | |
| ⑤ | 鉴别:AlCl3、Al2(SO4)3溶液 |