题目内容
15.下列反应的离子方程式书写正确的是( )| A. | 用氢氧化钠溶液中和稀硝酸:H++OH-═H2O | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 铜与硝酸银溶液的反应:Cu+Ag+═Cu2++Ag |
分析 A.二者反应生成硝酸钠和水;
B.不符合反应客观事实;
C.漏掉氢离子与氢氧根离子的反应;
D.电荷不守恒.
解答 解:A.用氢氧化钠溶液中和稀硝酸,离子方程式:H++OH-═H2O,故A正确;
B.稀H2SO4与铁粉反应生成硫酸亚铁和氢气,离子方程式:Fe+2H+═Fe2++H2↑,故B错误;
C.氢氧化钡溶液与稀H2SO4反应,离子方程式:2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O,故C错误;
D.铜与硝酸银溶液的反应,离子方程式:Cu+2Ag+═Cu2++2Ag,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
1.下列实验操作中,不正确的是( )
| A. | 金属钠在用小刀切割后,剩余的钠应放回煤油中 | |
| B. | 焰色反应实验前,铂丝应先用盐酸洗涤后灼烧至无色,焰色反应是一种物理变化 | |
| C. | 实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管伸入液面下 | |
| D. | 将烧碱溶液保存在磨口的细口玻璃瓶中 |
6.加热13.7g Na2CO3和NaHCO3的固体混合物至质量不再发生变化,剩余固体质量为10.6g,则混合物中Na2CO3的质量分数约为( )
| A. | 84% | B. | 50% | C. | 16% | D. | 39% |
3.将浓度为0.1mol•L-1HF溶液加水不断稀释,下列各量始终保持增大的是( )
| A. | [H+] | B. | Ka(HF) | C. | $\frac{[{F}^{-}]}{[{H}^{+}]}$ | D. | $\frac{[{H}^{+}]}{[HF]}$ |
20.下列措施或事实能用勒夏特列原理解释的是( )
| A. | 在合成氨的反应中,高温、高压有利于氨的合成 | |
| B. | H2、I2、HI平衡混合气加压后颜色变深 | |
| C. | 保存FeSO4溶液时需要往里加入光亮的铁钉 | |
| D. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
7.只用一种试剂或操作即可除去少量杂质或鉴别物质,将该试剂或操作名称填在空格处.
写出以上表格中对应的离子反应:①CO2+CO32-+H2O=2HCO3-;②Al2O3+2OH-=2AlO2-+H2O;③Fe+2Fe3+=3Fe2+.
| 编号 | 物质 | 试剂或操作名称 |
| ① | 除杂质:NaHCO3溶液(Na2CO3) | |
| ② | 除杂质:MgO(Al2O3) | |
| ③ | 除杂质:FeCl2溶液(FeCl3) | |
| ④ | 鉴别:NaCl、KCl | |
| ⑤ | 鉴别:AlCl3、Al2(SO4)3溶液 |
4.下列说法正确的是( )
| A. | 分子式为C7H8O,且含苯环的有机化合物有4种 | |
| B. | 乙醇能使酸性高锰酸钾溶液褪色 | |
| C. | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的使酸性KMnO4溶液褪色的气体只是乙烯 | |
| D. | 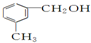 遇FeCl3溶液可显紫色 遇FeCl3溶液可显紫色 |
5.下列说法正确的是( )
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 任何反应中的能量变化都表现为热量变化 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 所有化学反应都可以设计成原电池 |
