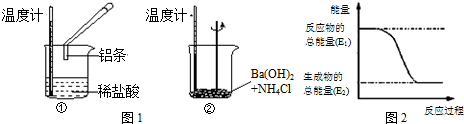
题目内容
16.一定条件下,可逆反应A2(g)+B2(g)?2C(g)达到平衡时,各物质的平衡浓度分别为c(A2)=0.4mol•L-1;c(B2)=0.1mol•L-1;c(C)=1.6mol•L-1.(1)若反应开始时,反应容器中未加入B,10S后达到平衡,则10S内用C的浓度变化表示的化学反应速率为0.02mol•L-1•s-1.
(2)若A2、B2、C的初始浓度分别用a、b、c表示(mol•L-1),则:a、b应满足的关系是a-b=0.3.a的取值范围是0.3≤a≤1.2.
分析 (1)10s内△c(B2)=0.1mol•L-1,带入v(B2)=$\frac{△c({B}_{2})}{△t}$计算,然后根据化学反应速率之比等于化学计量数之比计算v(C);
(2)根据参加反应的A2和B2的浓度相同,故二者平衡浓度之差应等于起始浓度之差,依此进行计算;平衡从正向和逆向分别建立,依此利用三段式进行计算.
解答 解:(1)10s内△c(B2)=0.1mol•L-1,v(B2)=$\frac{0.1mol•L{\;}^{-1}}{10s}$=0.01mol•L-1•s-1,v(C)=2v(B2)=2×0.01mol•L-1•s-1=0.02 mol•L-1•s-1,
故答案为:0.02 mol•L-1•s-1;
(2)A2(g)+B2(g)?2C(g),参加反应的A2和B2的浓度相同,故二者平衡浓度之差应等于起始浓度之差,即a-b=0.4-0.1=0.3,
若平衡从正向建立,则
A2(g)+B2(g)?2C(g)
起始:a b 0
转化:a-0.4 b-0.1 1.6
平衡:0.4 0.1 1.6
$\frac{a-0.4}{1.6}$=$\frac{1}{2}$,a=1.2mol/L,
若平衡从逆向建立,则
A2(g)+B2(g)?2C(g)
起始:a 0 c
转化:0.1 0.1 0.2
平衡:0.4 0.1 1.6
a+0.1=0.4,a=0.3mol/L,
故a的取值范围为:0.3≤a≤1.2
故答案为:a-b=0.3;0.3≤a≤1.2.
点评 本题考查化学反应速率、化学平衡的相关计算,题目难度中等,要注意运用三段式进行计算.

练习册系列答案
相关题目
6.已知:①H+(aq)+OH-(aq)═H2O(l);△H1;②2SO2(g)+O2(g)?2SO3(g);△H2.其他条件不变时,改变反应物的量,则下列判断正确的是( )
| A. | △H1,△H2都不变 | B. | △H1,△H2都增大 | C. | △H1,△H2都减小 | D. | 不能确定 |
7.下列说法中,不正确的是( )
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 禁止用工业酒精配制饮用酒和调味用的料酒 | |
| D. | 溴乙烷、TNT、丙三醇都是无色溶于水的有机化合物 |
4.设NA为阿佛加德罗常数的值,下列叙述正确的是( )
| A. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA | |
| B. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| C. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| D. | 常温下,4gCH4含有NA 个C-H共价键 |
11.电子表和电子计算器的电源通常用微型银-锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,电极总反应为:Ag2O+H2O+Zn=Zn(OH)2+2Ag.下列叙述正确的是( )
| A. | Zn是正极,Ag2O是负极 | |
| B. | 工作时电子由Zn极经溶液移向Ag2O极 | |
| C. | 该电池可将化学能100%转化为电能 | |
| D. | Zn是负极,反应为Zn-2 e-+2OH-=Zn(OH)2 |
8.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F-离子结构示意图 | ||
| C. | 次氯酸电子式 | D. | 用电子式表示HCl形成过程 |
5.有A、B、C、D、E五种短周期元素,其元素特征信息如下表.回答下列问题:
(1)写出下列元素的符号:B:O,E:Cl;
(2)写出C与B 形成的两种离子化合物的化学式Na2O;Na2O2.
(3)写出B与A 形成的两种化合物的电子式 ;
;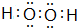 .
.
(4)含B、C、F 三种元素的化合物有Na2SO4、Na2SO3(请填写具体的化学式,至少2种).
(5)D单质和C的最高价氧化物对应水化物水溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.
(6)FB2和E元素的单质在水溶液中反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
(7)D的单质和氧化铁反应可用于野外焊接钢轨,该反应属于放热 (填“吸热”或“放热”)反应,写出反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
| 元素编号 | 元素特征信息 |
| A | 是原子半径最小的元素 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 是短周期元素中原子半径最大的主族元素. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
| F | 原子有三个电子层,且最外层电子数是最内层电子数的3倍, |
(2)写出C与B 形成的两种离子化合物的化学式Na2O;Na2O2.
(3)写出B与A 形成的两种化合物的电子式
 ;
;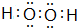 .
.(4)含B、C、F 三种元素的化合物有Na2SO4、Na2SO3(请填写具体的化学式,至少2种).
(5)D单质和C的最高价氧化物对应水化物水溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.
(6)FB2和E元素的单质在水溶液中反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
(7)D的单质和氧化铁反应可用于野外焊接钢轨,该反应属于放热 (填“吸热”或“放热”)反应,写出反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
8.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏高的是( )
| A. | 酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 酸式滴定管读数时,滴定前正确读数,滴定后俯视读数 | |
| D. | 盛NaOH溶液的锥形瓶滴定前未干燥,带有水珠 |