题目内容
1.某实验小组同学进行如下实验,以检验化学反应中的能量变化.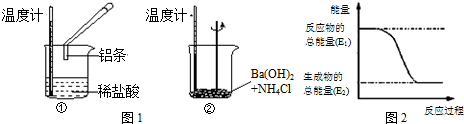
请回答下列问题:
(1)反应①是放热反应,其离子方程式是2Al+6H+═2Al3++3H2↑.Ba(OH)2•8H2O与NH4Cl的反应是吸 热反应.其化学方程式是Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O. 反应过程① (填“①”或“②”)的能量变化可用图2表示.
(2)现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2
①以上两个反应能设计成原电池的是B.
②写出设计原电池正极电极反应式2Fe3++2e-=2Fe2+.
分析 (1)化学反应中,温度升高,则反应放热;温度降低则反应吸热;图2中反应物总能量大于生成物总能量,该反应为放热反应,据此进行解答;
(2)①自发进行的放热的氧化还原反应能设计成原电池;
②该原电池中,失电子的金属单质作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,负极上Cu失电子发生氧化反应、正极上铜离子得电子发生还原反应.
解答 解:(1)Al与HCl反应后,温度升高,则说明反应放热,离子反应方程式为:2Al+6H+═2Al3++3H2↑;Ba(OH)2•8H2O与NH4Cl的反应温度降低,说明反应为吸热反应,化学反应方程式为:Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3;反应①为放热反应,反应物的总能量大于生成物的总能量,所以①的能量变化可用图2表示;故答案为:放;2Al+6H+═2Al3++3H2↑;吸;Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3;①;
(2)①自发进行的放热的氧化还原反应能设计成原电池,A反应中没有电子转移,不属于氧化还原反应,所以不能设计成原电池;B属于自发进行的放热的氧化还原反应,所以能设计成原电池,故答案为:B;
②该原电池中,Cu失电子作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,正极上铜离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,负极上Cu失电子发生氧化反应,电极反应式为:Cu-2e-═Cu2+;故答案为:2Fe3++2e-=2Fe2+.
点评 本题考查学生根据实验现象判断放热与吸热反应,原电池设计,难度不大,侧重于基础知识的考查,注意把握实验原理.

练习册系列答案
相关题目
11.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,各原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述不正确的是( )
| A. | D元素处于元素周期表中第三周期ⅣA族 | |
| B. | 四种元素的原子半径:A<B<D<C | |
| C. | B、D的氧化物均为酸性氧化物 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
12.胡椒粉是植物挥发油的成分之一.它的结构式为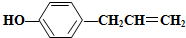 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
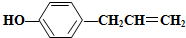 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A. | 1 mol胡椒粉最多可与4 mol氢气发生反应 | |
| B. | 1 mol胡椒粉最多可与3 mol溴水发生反应 | |
| C. | 胡椒粉可与氯化铁溶液反应,使溶液呈紫色 | |
| D. | 胡椒粉与NaHCO3溶液反应产生CO2 |
9.下列说法正确的是( )
| A. | 同周期X、Y、Z元素的最高价含氧酸的酸性:HXO4>H2YO4>H3ZO4,则气态氢化物还原性HX<H2Y<ZH3 | |
| B. | 元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4 | |
| C. | 金属与非金属元素分界线附近的元素是过渡元素 | |
| D. | 物质的量相同的Na+、O2-、NH3三种微粒,一定含有相同的质子 |
6.某周期的第ⅠA族元素的原子序数为x,那么同一周期第ⅢA族元素的原子序数为( )
| A. | 肯定是x+2 | B. | 肯定是x+2或x+8或x+32 | ||
| C. | 肯定是x+2或x+12或x+26 | D. | 肯定是x+2或x+10或x+26 |
13.实验探究题某课外实验小组为了探究锌与盐酸反应过程中的化学反应速率的变化,在100mL稀盐酸中加入足量的锌粉,标准状况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大,可能的原因是2~3 min;该反应是放热反应,温度升高,反应速率加快;.
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为0.1mol/(L•min).
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是AB(填编号).
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为0.1mol/(L•min).
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是AB(填编号).
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1盐酸的澄清透明溶液:Fe3+、Na+、SO42-、Br- | |
| B. | pH=1的溶液中:Na+、K+、MnO4-、HCO3- | |
| C. | 能使石蕊变红的溶液:Cu2+、Na+、AlO2-、Cl- | |
| D. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、Cl- |
13.实验室用已知浓度的盐酸滴定未知浓度的NaOH溶液,下列操作会使所测NaOH浓度偏低的是( )
| A. | 滴定前,未用NaOH溶液对锥形瓶进行润洗 | |
| B. | 滴定过程中,有少量盐酸滴在锥形瓶外 | |
| C. | 盛装盐酸前,未对酸式滴定管进行润洗 | |
| D. | 滴定终点时,对酸式滴定管俯视读数 |