题目内容
11.电子表和电子计算器的电源通常用微型银-锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,电极总反应为:Ag2O+H2O+Zn=Zn(OH)2+2Ag.下列叙述正确的是( )| A. | Zn是正极,Ag2O是负极 | |
| B. | 工作时电子由Zn极经溶液移向Ag2O极 | |
| C. | 该电池可将化学能100%转化为电能 | |
| D. | Zn是负极,反应为Zn-2 e-+2OH-=Zn(OH)2 |
分析 根据电池反应式知,锌失电子发生氧化反应而作负极,电极反应式为:Zn-2e-+2OH-═Zn(OH)2,氧化银得电子发生还原反应而作正极,电极反应式为:Ag2O+2e-+H2O═2Ag+2OH-,电子从负极沿导线流向正极,据此分析解答.
解答 解:A.根据电池反应式知,Zn失电子化合价升高而作负极,Ag2O作正极,故A错误;
B.锌作负极,氧化银作正极,电子从负极锌沿导线流向正极氧化银,不经过溶液,故B错误;
C.电池中还有部分化学能转化为热能,所以能量转化率不是100%,故C错误;
D.根据电池反应式知,锌失电子发生氧化反应而作负极,电极反应式为:Zn-2e-+2OH-═Zn(OH)2,故D正确;
故选D.
点评 本题考查了化学电源新型电池,题目难度不大,明确原电池工作原理为解答关键,注意先根据电池反应式中元素化合价变化来确定正负极,再结合导致移动方向、离子浓度的变化来分析解答,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.简单原子的原子结构可用下图的表示方法形象表示,其中●表示质子或电子,○表示中子,则有关①②③的叙述正确的是( )

| A. | ①②③是化学性质不同的粒子 | B. | ①不是核素,②③才是核素 | ||
| C. | ①②③具有相同的质量数 | D. | ①②③互为同位素 |
2.下列物质属于纯净物的是( )
| A. | 汽油 | B. | 福尔马林 | C. | 冰醋酸 | D. | 聚氯乙烯 |
6.可逆反应2NO2?2NO+O2在恒容密闭容器中进行,下列情况达到平衡状态的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体压强不再改变.
①单位时间内生成n mol O2的同时生成2n mol NO2
②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体压强不再改变.
| A. | ①②④⑥ | B. | ②③⑤ | C. | ①②⑤⑥ | D. | ①②④⑤ |
3.现有部分短周期元素的性质与原子(或分子)结构如下表:
(1)画出元素T的原子结构示意图 ;
;
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号);
a.Y单质的熔点比Z单质低b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式Na2O2,并写出该化合物与水反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素T和氢元素形成的化合物属于共价化合物,元素Z与元素T形成的化合物属于离子化合物(以上两空选填“共价化合物”或“离子化合物”).
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
 ;
;(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号);
a.Y单质的熔点比Z单质低b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式Na2O2,并写出该化合物与水反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素T和氢元素形成的化合物属于共价化合物,元素Z与元素T形成的化合物属于离子化合物(以上两空选填“共价化合物”或“离子化合物”).
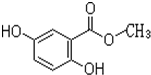 .
.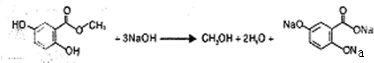 .
.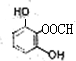 、
、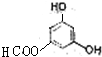 .
.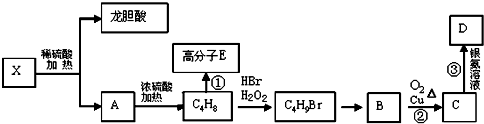
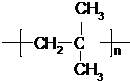 .
.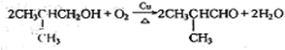 .
.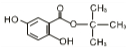 .
.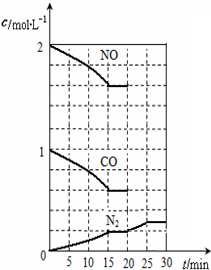 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.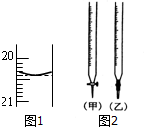 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题: