题目内容
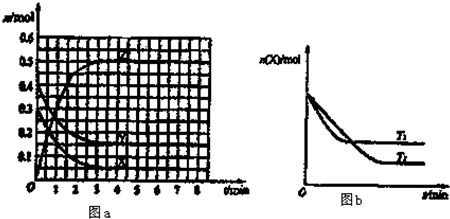
T0℃时,在2L的恒容密闭容器中发生反应:X(g)+Y(g)?Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述正确的是( )

| A、该反应的正反应是吸热反应 |
| B、T0℃,从反应开始到平衡时:v(X)=0.083 mol?L-1?min-1 |
| C、图a中反应达到平衡时,Y的转化率为37.5% |
| D、T0℃在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,Z体积分数不变 |
考点:物质的量或浓度随时间的变化曲线,体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:该反应达到平衡状态时,X浓度的变化量=(0.3-0.05)mol/L=0.25mol/L,Y浓度的变化量=(0.4-0.15)mol/L=0.25 mol/L,Z浓度的变化量=(0.5-0)mol/L=0.5mol/L,所以该反应的方程式为X(g)+Y(g)?2Z(g),
A.升高温度,平衡向吸热反应方向移动,根据Z浓度的变化判断温度高低;
B.根据v=
计算;
C.由图a可知,Y的起始浓度为0.4mol/L,平衡时Y的物质的量浓度为0.15mol/L,Y的浓度变化为0.25mol/L.结合转化率定义计算;
D.根据增加反应物浓度平衡向正反应方向移动的原理判断平衡移动,根据等效平衡的原理判断Z体积分数的变化情况.
A.升高温度,平衡向吸热反应方向移动,根据Z浓度的变化判断温度高低;
B.根据v=
| △C |
| △t |
C.由图a可知,Y的起始浓度为0.4mol/L,平衡时Y的物质的量浓度为0.15mol/L,Y的浓度变化为0.25mol/L.结合转化率定义计算;
D.根据增加反应物浓度平衡向正反应方向移动的原理判断平衡移动,根据等效平衡的原理判断Z体积分数的变化情况.
解答:
解:该反应达到平衡状态时,X浓度的变化量=(0.3-0.05)mol/L=0.25mol/L,Y浓度的变化量=(0.4-0.15)mol/L=0.25 mol/L,Z浓度的变化量=(0.5-0)mol/L=0.5mol/L,所以该反应的方程式为X(g)+Y(g)?2Z(g),
A.由图b可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时Z的物质的量浓度越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,故A错误;
B.v(X)=
=
=0.042 mol?L-1?min-1,故B错误;
C.由图a可知,Y的起始浓度为0.4mol/L,平衡时Y的物质的量浓度为0.15mol/L,Y的浓度变化为0.25mol/L,所以Y的转化率为
=62.5%,故C错误;
D.根据增加反应物浓度平衡向正反应方向移动的原理可知,在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,由于该反应起始充入的物质也是0.4molY(g)、0.3molX(g),而该反应是气体体积不变的反应,压强对平衡没有影响,所以再充入0.4molY(g)、0.3molX(g),相当于把原平衡体积压缩为原来的一半,根据等效平衡的原理,可判断出Z体积分数不变,故D正确;
故选D.
A.由图b可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时Z的物质的量浓度越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,故A错误;
B.v(X)=
| △C |
| △t |
| ||
| 3min |
C.由图a可知,Y的起始浓度为0.4mol/L,平衡时Y的物质的量浓度为0.15mol/L,Y的浓度变化为0.25mol/L,所以Y的转化率为
| 0.25mol/L |
| 0.4mol/L |
D.根据增加反应物浓度平衡向正反应方向移动的原理可知,在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,由于该反应起始充入的物质也是0.4molY(g)、0.3molX(g),而该反应是气体体积不变的反应,压强对平衡没有影响,所以再充入0.4molY(g)、0.3molX(g),相当于把原平衡体积压缩为原来的一半,根据等效平衡的原理,可判断出Z体积分数不变,故D正确;
故选D.
点评:本题考查化学平衡图象问题、反应速率、转化率的有关计算、外界条件对平衡移动影响、等效平衡等,难度中等,根据图象确定反应方程式与判断反应为吸热反应是解题的关键.注意把握图象中曲线的变化特点,分析外界条件对化学平衡的影响.注意平衡图象先拐先平数值大原则与定一议二原则.

练习册系列答案
相关题目
根据下列反应的化学方程式:①Zn+CuSO4=ZnSO4+Cu、②Cu+2AgNO3=Cu(NO3)2+2Ag,判断三种金属的还原性强弱顺序是( )
| A、Zn>Cu>Ag |
| B、Zn>Ag>Cu |
| C、Cu>Ag>Zn |
| D、Ag>Cu>Zn |
下列化学用语的描述正确的是( )
| A、氨水显碱性:NH3?H2O═NH4++OH- |
| B、Na2S溶液显碱性:S2-+2H2O?H2S+2OH- |
| C、硫酸氢钠溶液显酸性:NaHSO4═Na++H++SO42- |
| D、AlCl3溶液显酸性:Al3++3H2O?Al(OH)3↓+3H+ |
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )
| A、0.01 mol?L-1的蔗糖溶液 |
| B、0.01 mol?L-1的CaCl2溶液 |
| C、0.01 mol?L-1的NaCl溶液 |
| D、0.02 mol?L-1的CH3COOH溶液 |
有甲、乙、丙三种试液,在氢氧化钡溶液中加入甲有白色沉淀生成,在沉淀中加入乙,沉淀完全溶解并产生气泡,最后向所得溶液中加入丙又产生白色沉淀,则甲、乙、丙依次是( )
| A、K2CO3、HCl、CaCl2 |
| B、Na2CO3、HNO3、MgSO4 |
| C、Na2CO3、HCl、Ba(NO3)2 |
| D、H2SO4、Na2CO3、AgNO3 |
工业酒精与用粮食发酵产生的酒精成份不完全相同.严禁用工业酒精勾兑食用酒,否则会使人双目失明甚至死亡.工业酒精中的主要有毒成份是( )
| A、甲醇 | B、甲醛 | C、甲酸 | D、甲苯 |
下列离子方程式书写正确的是( )
A、向苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO
| ||
| B、用硫酸铜溶液除去乙炔中的硫化氢气体:Cu2++S2-=CuS↓ | ||
C、乙酸与碳酸钙溶液反应:2CH3COOH+CO
| ||
| D、酸性高锰酸钾溶液中通入乙炔后紫色褪去:2MnO4-+6H++C2H2=2Mn2++2CO2+4H2O |
 汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.