题目内容
工业酒精与用粮食发酵产生的酒精成份不完全相同.严禁用工业酒精勾兑食用酒,否则会使人双目失明甚至死亡.工业酒精中的主要有毒成份是( )
| A、甲醇 | B、甲醛 | C、甲酸 | D、甲苯 |
考点:醇类简介
专题:有机化合物的获得与应用,化学应用
分析:甲醇是一种无色、透明、易挥发的有毒液体,略有乙醇的气味,工业酒精中大约含有4%的甲醇,被不法分子当作食用酒精制作假酒,而被人饮用后,就会产生甲醇中毒,使人双目失明甚至死亡.
解答:
解:工业酒精中大约含有4%的甲醇,甲醇是一种无色、透明、易挥发的有毒液体,略有乙醇的气味,不法分子用工业酒精当作食用酒精制作假酒,被人饮用后,就会产生甲醇中毒,使人双目失明甚至死亡,
故选:A.
故选:A.
点评:本题考查了工业酒精的成分以及甲醇的性质,题目难度不大,注意对课本基础知识的积累和记忆.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如将物质按照单质、氧化物、酸、碱、盐分类,下列各组物质中,类别相同的是( )
| A、氧气、氧化镁、四氯化碳、水 |
| B、硫酸铜、氯化钠、碳酸钙、硫化钾 |
| C、硫酸、碳酸钠、氯化镁、氧化钠 |
| D、硝酸银、氢氧化钠、醋酸钠、氯化钾 |
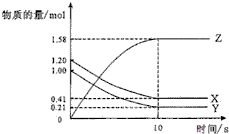 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )| A、达到平衡所需要的时间是10s |
| B、平衡时Y的转化率79.0% |
| C、该反应的化学方程式为X(g)+Y(g)?2Z(g) |
| D、前10s,用Z表示的反应速率为0.79mol/(L?s) |
实验室可提供下列实验操作:①滴加AgNO3溶液;②加NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取滤渣;⑦用HNO3酸化.如要鉴定1-氯丙烷中的氯元素,从中选择合适的操作步骤是( )
| A、③⑤⑦① | B、②③⑦① |
| C、②⑤⑦① | D、④②⑥① |
T0℃时,在2L的恒容密闭容器中发生反应:X(g)+Y(g)?Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述正确的是( )
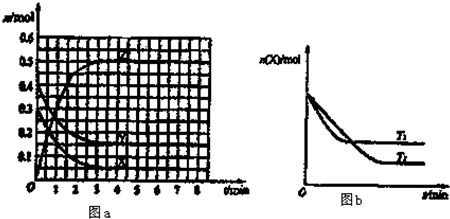

| A、该反应的正反应是吸热反应 |
| B、T0℃,从反应开始到平衡时:v(X)=0.083 mol?L-1?min-1 |
| C、图a中反应达到平衡时,Y的转化率为37.5% |
| D、T0℃在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,Z体积分数不变 |
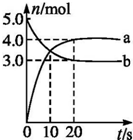 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )| A、0~20 s内平均反应速率v(N2O5)=0.1 mol?(L?s)-1 |
| B、10 s时,正、逆反应速率相等,达到平衡 |
| C、20 s时,正反应速率大于逆反应速率 |
| D、曲线a表示NO2的物质的量随反应时间的变化 |
 利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知:
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知: