题目内容
下列离子方程式书写正确的是( )
A、向苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO
| ||
| B、用硫酸铜溶液除去乙炔中的硫化氢气体:Cu2++S2-=CuS↓ | ||
C、乙酸与碳酸钙溶液反应:2CH3COOH+CO
| ||
| D、酸性高锰酸钾溶液中通入乙炔后紫色褪去:2MnO4-+6H++C2H2=2Mn2++2CO2+4H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应生成苯酚和碳酸氢钠;
B.硫化氢在离子反应中保留化学式;
C.碳酸钙在离子反应中保留化学式;
D.发生氧化还原反应,遵循电子、电荷守恒及质量守恒定律.
B.硫化氢在离子反应中保留化学式;
C.碳酸钙在离子反应中保留化学式;
D.发生氧化还原反应,遵循电子、电荷守恒及质量守恒定律.
解答:
解:A.向苯酚钠溶液中通入少量二氧化碳的离子反应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故A错误;
B.用硫酸铜溶液除去乙炔中的硫化氢气体的离子反应为Cu2++H2S=CuS↓+2H+,故B错误;
C.乙酸与碳酸钙溶液反应的离子反应为2CH3COOH+CaCO3→2CH3COO-+CO2↑+H2O+Ca2+,故C错误;
D.酸性高锰酸钾溶液中通入乙炔后紫色褪去的离子反应为2MnO4-+6H++C2H2=2Mn2++2CO2+4H2O,故D正确;
故选D.
B.用硫酸铜溶液除去乙炔中的硫化氢气体的离子反应为Cu2++H2S=CuS↓+2H+,故B错误;
C.乙酸与碳酸钙溶液反应的离子反应为2CH3COOH+CaCO3→2CH3COO-+CO2↑+H2O+Ca2+,故C错误;
D.酸性高锰酸钾溶液中通入乙炔后紫色褪去的离子反应为2MnO4-+6H++C2H2=2Mn2++2CO2+4H2O,故D正确;
故选D.
点评:本题考查离子反应书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及与量有关的离子反应的考查,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
下列有机化学反应中,属于消去反应的是( )
| A、苯与浓硫酸、浓硝酸混合,温度保持在50℃~60℃ |
| B、溴丙烷与氢氧化钠溶液混合,静置 |
| C、乙醇与浓硫酸共热,温度保持在170℃ |
| D、1-氯丁烷与氢氧化钾水溶液共热 |
 维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.下列有关维生素A的认识不正确的是( )
维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.下列有关维生素A的认识不正确的是( )| A、维生素A的分子式为C18H28O |
| B、一定条件下,维生素A能被酸性KMnO4溶液氧化 |
| C、维生素A可使溴水褪色 |
| D、1mol维生素A分子最多可跟5 mol H2发生加成反应 |
T0℃时,在2L的恒容密闭容器中发生反应:X(g)+Y(g)?Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述正确的是( )
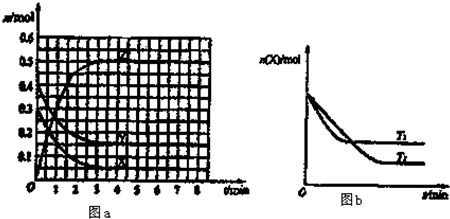

| A、该反应的正反应是吸热反应 |
| B、T0℃,从反应开始到平衡时:v(X)=0.083 mol?L-1?min-1 |
| C、图a中反应达到平衡时,Y的转化率为37.5% |
| D、T0℃在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,Z体积分数不变 |
NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、在常温常压下,14 gN2含有的分子数为0.5NA |
| B、50 mL1 mol/L的Na2SO4溶液中含Na+数为NA |
| C、标准状况下,22.4 L H2和O2的混合气体所含分子数为NA |
| D、24 g Mg与盐酸充分反应转移电子数为NA |
液态化合物AB会发生微弱的自身电离,电离方程式为AB?A++B-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14.则下列叙述正确的是( )
| A、AB的电离是吸热过程 |
| B、在35℃时,c(A+)>c(B-) |
| C、AB的电离程度(25℃)>(35℃) |
| D、c(A+)随温度升高而降低 |
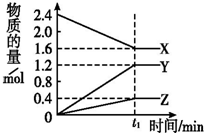 某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:
某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示: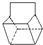 )是双环戊二烯的一种同分异构体,它的一氯代物有
)是双环戊二烯的一种同分异构体,它的一氯代物有