题目内容
根据下列反应的化学方程式:①Zn+CuSO4=ZnSO4+Cu、②Cu+2AgNO3=Cu(NO3)2+2Ag,判断三种金属的还原性强弱顺序是( )
| A、Zn>Cu>Ag |
| B、Zn>Ag>Cu |
| C、Cu>Ag>Zn |
| D、Ag>Cu>Zn |
考点:常见金属的活动性顺序及其应用
专题:几种重要的金属及其化合物
分析:依据氧化还原反应中还原剂的还原性大于还原产物的还原性可以比较三种金属的还原性强弱.
解答:
解:反应①Zn+CuSO4=ZnSO4+Cu中,锌元素化合价升高被氧化,所以锌为还原剂;CuSO4中铜离子得到电子被还原为铜,所以铜为还原产物,所以还原性顺序:Zn>Cu;
反应、②Cu+2AgNO3=Cu(NO3)2+2Ag,铜元素化合价升高被氧化,所以铜为还原剂;AgNO3中银离子得到电子被还原为银,所以银为还原产物,所以还原性顺序:Cu>Ag;
所以三种金属的还原性强弱顺序:Zn>Cu>Ag;
故选:A.
反应、②Cu+2AgNO3=Cu(NO3)2+2Ag,铜元素化合价升高被氧化,所以铜为还原剂;AgNO3中银离子得到电子被还原为银,所以银为还原产物,所以还原性顺序:Cu>Ag;
所以三种金属的还原性强弱顺序:Zn>Cu>Ag;
故选:A.
点评:本题考查了金属还原性强弱顺序的比较,解题关键依据化合价的升降判断还原剂和还原产物,依据还原剂的还原性大于还原产物的还原性,题目难度不大.

练习册系列答案
相关题目
下列物质是电解质的是( )
| A、稀硫酸 | B、熔融的氯化钠 |
| C、酒精 | D、铜 |
下列说法中正确的是( )
| A、S、N的氧化物使雨水的pH<7,pH<7的降水为酸雨 |
| B、淀粉中加入稀硫酸加热后,再加入银氨溶液水浴加热有银镜出现 |
| C、淀粉、纤维素的化学式相同,二者互为同分异构体 |
| D、氨基酸和蛋白质既能与酸反应又能与碱反应 |
 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )①镁为正极
②电子由铝片通过导线流向镁片
③该电池的内电路中,阳离子向负极迁移
④镁片上发生的反应为:Mg-2e-═Mg2+
⑤该装置能够将电能转化为化学能
⑥负极反应为 Al-3e-+4OH-═AlO2-+2H2O
⑦正极发生还原反应,负极发生氧化反应
⑧Al是电池负极,开始工作时溶液中会立即有白色沉淀析出.
| A、①②⑦⑧ | B、③④⑤⑥ |
| C、①②⑥⑦ | D、②③⑤⑧ |
 室温下,用0.100mol?L-1 NaOH溶液分别滴定20.00mL 0.100mol?L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol?L-1 NaOH溶液分别滴定20.00mL 0.100mol?L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A、Ⅱ表示的是滴定醋酸的曲线 |
| B、pH=7时,滴定醋酸消耗的V(NaOH)小于20mL |
| C、V(NaOH)=20.00mL时,两份溶液中c(Cl-)=c(CH3COO-) |
| D、V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
如将物质按照单质、氧化物、酸、碱、盐分类,下列各组物质中,类别相同的是( )
| A、氧气、氧化镁、四氯化碳、水 |
| B、硫酸铜、氯化钠、碳酸钙、硫化钾 |
| C、硫酸、碳酸钠、氯化镁、氧化钠 |
| D、硝酸银、氢氧化钠、醋酸钠、氯化钾 |
下列有机化学反应中,属于消去反应的是( )
| A、苯与浓硫酸、浓硝酸混合,温度保持在50℃~60℃ |
| B、溴丙烷与氢氧化钠溶液混合,静置 |
| C、乙醇与浓硫酸共热,温度保持在170℃ |
| D、1-氯丁烷与氢氧化钾水溶液共热 |
下列比较中正确的是( )
| A、溶液碱性:KOH>LiOH |
| B、溶液酸性:HNO3<H2CO3 |
| C、原子半径:S<F |
| D、硫与氢气反应比氟与氢气反应更容易 |
T0℃时,在2L的恒容密闭容器中发生反应:X(g)+Y(g)?Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述正确的是( )
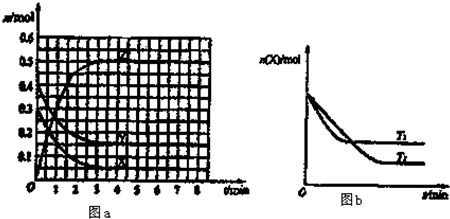

| A、该反应的正反应是吸热反应 |
| B、T0℃,从反应开始到平衡时:v(X)=0.083 mol?L-1?min-1 |
| C、图a中反应达到平衡时,Y的转化率为37.5% |
| D、T0℃在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,Z体积分数不变 |