题目内容
10.有下列微粒:①11H;②21H;③31H;④16O;⑤18O;⑥12C;⑦14C;⑧40K;⑨40Ca;⑩35Cl2;⑪37Cl2,回答以下问题(填序号):(1)以上11种微粒共含有11种核素,属于6种元素.
(2)互为同位素的是①②③;④⑤;⑥⑦.
(3)质量数相等的微粒是⑧⑨.
(4)形成的水分子共有12种.
分析 (1)质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;
(2)质子数相同,而中子数不同的原子,互称为同位素;
(3)原子符号左上角的数字为质量数;
(4)根据水的组成是由氢、氧元素组成,在1个水分子中含有2个氢原子和1个氧原子来分析解答.
解答 解:(1)以上11种微粒共含有:11H;12H;13H;16O;18O;12C;14C;40K;40Ca;35Cl2;37Cl2共11种核素,其中11H、12H、13H都属于氢元素,16O;8O都属于氧元素,12C;14C都属于碳元素,40K属于钾元素,40Ca属于钙元素,35Cl;37Cl属于氯元素,共6种元素;
故答案为:11;6;
(2)11H;12H;13H是质子数相同,而中子数不同的原子,互称为同位素;
16O、18O是质子数相同,而中子数不同的原子,互称为同位素;
12C、14C是质子数相同,而中子数不同的原子,互称为同位素;
故答案为:①②③;④⑤;⑥⑦;
(3)40K、40Ca的质量数都是40,
故答案为:⑧⑨;
(4)由氧的同位素有16O、18O,氢的同位素有11H、12H、13H,在1个水分子中含有2个氢原子和1个氧原子,
若水分子中的氢原子相同,
则16O可分别与11H、12H、13H构成水,即存在三种水;
18O可分别与11H、12H、13H构成水,即存在三种水;
若水分子中的氢原子不同,
则16O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
18O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
所以共形成3×4=12种水,
故答案为:12.
点评 本题主要考查了核数的种类、元素的种类、同位素的概,难度中等,掌握概念即可完成.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| B. | 要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| C. | 除去溴苯中少量的溴,可以加水后分液 | |
| D. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 |
| A. | 干燥的氯气 | B. | 潮湿的氯气 | C. | 干燥的次氯酸钙 | D. | 氯化钙 |
| A. | 2 mol/L | B. | 1.8 mol/L | C. | 1.9 mol/L | D. | 无法计算 |
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({B}^{-})}{c({A}^{-})}$减小 | |
| C. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| D. | 溶液中水的电离程度:a=c>b |
| A. | 每消耗1molCH4可以向外电路提供4mole- | |
| B. | 电池放电后,溶液PH不断升高 | |
| C. | 负极上O2得到电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 负极上CH4失去电子,电极反应式:CH4+10OH--8e-═CO32-+7H2O |
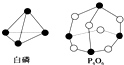 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )| A. | 放热1638 kJ | B. | 吸热1638 kJ | C. | 吸热3276 kJ | D. | 放热3276 kJ |
 请根据下表,回答下列问题:(数据均在25℃时测定)
请根据下表,回答下列问题:(数据均在25℃时测定)| 化学式 | CH3COOH | H2CO3 | HClO | Cu(OH)2 |
| 相关常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 | Ksp=2×10-20 |
(2)常温下0.1mol•L-1的HClO溶液加水稀释过程,下列表达式的数据不变的是D;
A.c (H+) B.$\frac{c({H}^{+})}{c(HClO)}$C.$\frac{c(O{H}^{-})}{c({H}^{+})}$D.$\frac{c(Cl{O}^{-})}{c(HClO)•c(O{H}^{-})}$
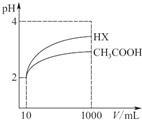
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示,则Ka(HX)> (选填>、=、<,下同) Ka(CH3COOH);若将浓度为c1的NaOH溶液与0.1mol/L的HX等体积混合,
所得溶液的pH=7,则c1<0.1mol/L,溶液中离子浓度的大小关系为:c(Na+)=c(X-)>c(OH-)=c(H+);若将“0.1mol/L的HX”改为“pH=1的HX”,所得溶液的pH仍为7,则c1>0.1mol/L.
(4)室温下,如果将0.1mol CH3COONa和0.05mol HCl溶于水,形成混合溶液(体积不变)
①CH3COOH和CH3COO-两种粒子的物质的量之和等于0.1mol.
②CH3COO-和OH-两种粒子的物质的量之和比H+多0.05mol.
(5)某硫酸铜溶液里c(Cu2+)=0.02mol•L-1,如要生成Cu(OH)2,应调整溶液pH,使之大于5;要使0.2mol•L-1硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液,使溶液pH为6.