题目内容
5.硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液.(1)制备莫尔盐的流程如图:
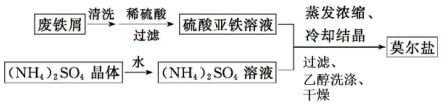
①用热的Na2CO3溶液清洗废铁屑的目的是除去废铁屑表面的油污.
②其中最后一步用少量无水乙醇洗涤晶体目的是洗去晶体表面杂质,减少晶体损失.
(2)现取0.4gCu2S和CuS的混合物在酸性溶液中用40mL0.150mol•L-1KMnO4溶液处理,发生反应如下:8MnO4-+5Cu2S+44H+═10Cu2++5SO2+8Mn2++22H2O,6MnO4-+5CuS+28H+═5Cu2++5SO2+6Mn2++14H2O,
反应后煮沸溶液,赶尽SO2,剩余的KMnO4用0.2mol•L-1(NH4)2Fe(SO4)2溶液来滴定,完全反应消耗(NH4)2Fe(SO4)2溶液VmL.已知:MnO4-+Fe2++H+→Mn2++Fe3++H2O(未配平)
①滴定终点的现象为滴入最后一滴溶液时红色褪去,半分钟内不变红.
②若V=35,试计算混合物中CuS的质量分数60%(写出计算过程).
分析 (1)废铁屑用热的Na2CO3溶液清洗,除去表面的油污,加入稀硫酸溶解过滤得到硫酸亚铁溶液和硫酸铵晶体失去结晶水得到的硫酸铵溶液混合蒸发浓缩、冷却结晶过滤,乙醇洗涤干燥得到摩尔盐,
①碳酸钠溶液中碳酸根离子水解溶液显碱性,油脂在碱溶液中水解生成溶于水的物质;
②晶体不溶于乙醇,乙醇易挥发,洗涤表面杂质;
(2)①剩余的KMnO4用0.2mol•L-1(NH4)2Fe(SO4)2溶液来滴定,溶液紫红色褪去半分钟不变说明反应达到终点;
②8MnO4-+5Cu2S+44H+═10Cu2++5SO2+8Mn2++22H2O,
6MnO4-+5CuS+28H+═5Cu2++5SO2+6Mn2++14H2O,
剩余的KMnO4用0.2mol•L-1(NH4)2Fe(SO4)2溶液来滴定,配平MnO4-+Fe2++H+→Mn2++Fe3++H2O,结合反应定量关系计算未反应的高锰酸钾,得到与0.4gCu2S和CuS的混合物反应的高锰酸钾,得到成分的质量分数.
解答 解:(1)①用热的Na2CO3溶液清洗废铁屑的目的是:除去废铁屑表面的油污,
故答案为:除去废铁屑表面的油污;
②其中最后一步用少量无水乙醇洗涤晶体目的是:洗去晶体表面杂质,减少晶体损失,
故答案为:洗去晶体表面杂质,减少晶体损失;
(2)①取0.4gCu2S和CuS的混合物在酸性溶液中用40mL0.150mol•L-1KMnO4溶液处理,反应后煮沸溶液,赶尽SO2,剩余的KMnO4用0.2mol•L-1(NH4)2Fe(SO4)2溶液来滴定,当滴入最后一滴,溶液红色褪去半分钟内不变红,说明反应达到反应终点,
故答案为:滴入最后一滴溶液时红色褪去,半分钟内不变红;
②V=35,与35mL(NH4)2Fe(SO4)2溶液完全反应需要高锰酸钾的物质的量为:
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1mol 5mol
n=0.014mol 0.035L×0.2mol•L-1
所以高锰酸钾的物质的量为0.0014mol,
故与固体混合物反应的高锰酸钾的物质的量为:0.150mol•L-1×0.040L-0.0014mol═0.0046mol
设Cu2S物质的量为x,CuS物质的量为y
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
8mol 5mol
$\frac{8x}{5}$mol xmol
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
6mol 5mol
$\frac{6y}{5}$mol ymol
160x+96y=0.40g
$\frac{8x}{5}$mol+$\frac{6y}{5}$mol=0.0046mol
解得x=0.001mol,
y=0.0025mol
则混合物中CuS的质量分数=$\frac{0.0025mol×96g/mol}{0.4g}$×100%=60%,
故答案为:60%.
点评 本题考查了物质制备流程分析判断物质性质和试剂选择、滴定实验过程和计算、沉淀生成、洗涤、检验等实验基本操作,掌握基础是关键,题目难度中等.

| A. | 乙醇不能与NaOH溶液反应,苯酚可以与NaOH溶液反应,说明苯环对羟基产生影响 | |
| B. | 苯不能被酸性KMnO4溶液氧化,甲苯可以被酸性KMnO4溶液氧化为苯甲酸,说明侧链对苯环产生了影响 | |
| C. | 苯与苯酚与溴水反应的条件、产物区别,说明羟基对苯环产生影响 | |
| D. | 苯和甲苯硝化反应产物的区别,说明甲基对苯环产生影响 |
| A. | C2H5OH+3O2=2CO2+3H2O△H=-1367.0 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3 kmol-1 | |
| C. | S(s)+O2(g)=SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO(g)+O2(g)=2NO2(g)△H=-116.2 kJ |
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol•L-1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?不行.(填“行”或“不行”)
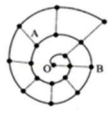 某同学在研究前 18 号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧 线上的“.”代表一种元素,其中 O 点代表氢元素.下列说法中错误的是( )
某同学在研究前 18 号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧 线上的“.”代表一种元素,其中 O 点代表氢元素.下列说法中错误的是( )| A. | B 元素是图中金属性最强的元素 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | 离 O 点越远的元素原子半径越大 | |
| D. | A、B 两种元素组成的化合物中可能含有共价键 |
| A. | Na | B. | SO2 | C. | Na2O2 | D. | NO2 |
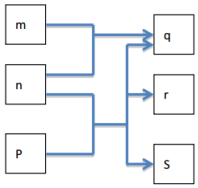 短周期元素W、X、Y、Z分别属于三个周期,其原子序数依次增大,Y的原子半径是短周期主族元素中最大的.由W、X、Y、Z组成的物质之间存在下图所示的转化关系,其中m是元素Y的单质,n是元素Z的单质,通常为黄绿色气体,s的水溶液常用作漂白剂和消毒剂.
短周期元素W、X、Y、Z分别属于三个周期,其原子序数依次增大,Y的原子半径是短周期主族元素中最大的.由W、X、Y、Z组成的物质之间存在下图所示的转化关系,其中m是元素Y的单质,n是元素Z的单质,通常为黄绿色气体,s的水溶液常用作漂白剂和消毒剂. .
.