题目内容
13.下列热化学方程式正确的是( )| A. | C2H5OH+3O2=2CO2+3H2O△H=-1367.0 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3 kmol-1 | |
| C. | S(s)+O2(g)=SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO(g)+O2(g)=2NO2(g)△H=-116.2 kJ |
分析 热化学方程式表示物质变化和能量变化,反应热与物质的聚集状态有关,单位为kJ/mol,以此解答该题.
解答 解:A.没有标出物质的聚集状态,故A错误;
B.中和反应为放热反应,反应热为负值,故B错误;
C.S的燃烧为放热反应,反应热为负值,且标出物质的聚集状态,故C正确;
D.NO与氧气的反应为放热反应,但单位错误,故D错误.
故选C.
点评 本题考查热化学方程式,为高频考点,把握热化学方程式的书写为解答的关键,侧重分析与应用能力的考查,注意把握热化学方程式的书写方法,题目难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
20.下列关于化学反应速率的说法中,不正确的是( )
| A. | 化学反应速率是化学反应进行快慢程度的物理量 | |
| B. | 化学反应速率的常用单位有mol/(L•s)和mol/(L•min) | |
| C. | 在同一个反应中,可以用反应物或生成物来表示反应速率 | |
| D. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 |
1.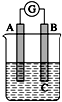 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )| A. | A是Zn,B是Cu,C为稀硫酸 | B. | A是Cu,B是Zn,C为稀硫酸 | ||
| C. | A是Fe,B是Ag,C为稀AgNO3溶液 | D. | A是Ag,B是Fe,C为稀AgNO3溶液 |
8. (1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
H2(g)═H2(l),△H=-0.92kJ/mol
O2(g)═O2(l),△H=-6.84kJ/mol
请写出液氢和液氧生成气态水的热化学方程式H2(l)+$\frac{1}{2}$O2(l)=H2O(g)△H=-237.46KJ/mol
(2)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,正极发生的电极反应式为O2+4e-+2H2O=4OH-.
(3)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2(g)+O2(g)?2N2O5(g)
已知体系中n(NO2)随时间变化如表:
①写出该反应的平衡常数表达式:K=$\frac{{C}^{2}({N}_{2}{O}_{5})}{{C}^{4}(N{O}_{2})×C({O}_{2})}$,已知:K300℃>K350℃,则该反应是放热反应
②达到平衡后,NO2的转化率为49.6%,此时若再通入量氮气,则NO2的转化率将不变(填“增大”、“减小”、“不变”);
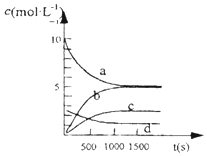
③右图中表示N2O5的浓度的变化曲线是c;
用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol/(L•s).
 (1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/molH2(g)═H2(l),△H=-0.92kJ/mol
O2(g)═O2(l),△H=-6.84kJ/mol
请写出液氢和液氧生成气态水的热化学方程式H2(l)+$\frac{1}{2}$O2(l)=H2O(g)△H=-237.46KJ/mol
(2)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,正极发生的电极反应式为O2+4e-+2H2O=4OH-.
(3)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2(g)+O2(g)?2N2O5(g)
已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(ml) | 20 | 13.96 | 10.08 | 10.08 |
②达到平衡后,NO2的转化率为49.6%,此时若再通入量氮气,则NO2的转化率将不变(填“增大”、“减小”、“不变”);
③右图中表示N2O5的浓度的变化曲线是c;
用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol/(L•s).
3.下列关于硅及其化合物性质的说法,正确的是( )
| A. | 硅的非金属性比碳强 | B. | SiO2可做太阳能电池 | ||
| C. | SiO2与氢氟酸能反应 | D. | 硅原子易失去或得到电子 |