题目内容
7. 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
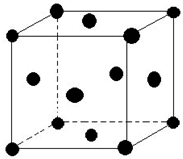
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.(用M、r、ρ表示)
分析 A基态原子最外层电子数是次外层的三倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,则A为O元素;B基态原子核外有13种不同运动状态的电子,则B为Al元素;C与B同一周期,原子中未成对电子数是同周期中最多的,则C为P元素; D2-的核外电子排布与氩原子相同,则D为S元素;E是ds区原子序数最小的元素,则E为Cu元素.
(1)B为Al,同周期原子序数比Al小的有Na、Mg,同周期元素第一电离能从左到右呈增大趋势,ⅡA、ⅤA族第一电离能高于同周期相邻元素的;
同主族自上而下电负性减小;
(2)O3分子中心原子孤电子对数=$\frac{6-2×2}{2}$=1,价层电子对数=2+1=3;原子数目相等、价电子总数也相等的微粒互为等电子体;
(3)乙醇中的羟基与水的羟基结构相似程度大,C7H15OH中烃基大,与水的羟基结构相似程度小;
C7H15OH分子中C原子、O原子的价层电子对均为4;
(4)[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键;若 Cu(NH3)42+具有对称的空间构型,且当 Cu(NH3)42+中的两个NH3分子被两个Cl取代时.能得到两种不同结构的产物,则 Cu(NH3)42+空间构型为平面正方形;
(5)根据均摊法计算晶胞中Cu原子数目,用阿伏伽德罗常数表示出晶胞质量,原子半径为r pm,则晶胞棱长d=$\frac{\sqrt{2}}{2}$×4r=2$\sqrt{2}$r,再结合m=ρV解答.
解答 解:A基态原子最外层电子数是次外层的三倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,则A为O元素;B基态原子核外有13种不同运动状态的电子,则B为Al元素;C与B同一周期,原子中未成对电子数是同周期中最多的,则C为P元素; D2-的核外电子排布与氩原子相同,则D为S元素;E是ds区原子序数最小的元素,则E为Cu元素.
(1)B为Al,同周期原子序数比Al小的有Na、Mg,同周期元素第一电离能从左到右呈增大趋势,因Mg原子3s轨道为全满稳定状态,则第一电离能大于Al的,所以第一电离能Mg>Al>Na,
同主族自上而下电负性减小,所以电负性O>S,
故答案为:Mg>Al>Na;>;
(2)O3分子中心原子孤电子对数=$\frac{6-2×2}{2}$=1,价层电子对数=2+1=3,分子构型为V形,O3分子原子数为3,价电子数为18,故其等电子体为SO2,
故答案为:V形;SO2;
(3)乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH分子中C原子、O原子的价层电子对均为4,所以采用sp3杂化的原子有8个原子,
故答案为:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小;8;
(4)[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,
若 Cu(NH3)42+具有对称的空间构型,且当 Cu(NH3)42+中的两个NH3分子被两个Cl取代时.能得到两种不同结构的产物,则 Cu(NH3)42+空间构型为平面正方形;
故答案为:①③;a;
(5)单质Cu晶胞中原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{M}{{N}_{A}}$g,原子半径为r pm,则晶胞棱长d=$\frac{\sqrt{2}}{2}$×4r=2$\sqrt{2}$r×10-10cm,则4×$\frac{M}{{N}_{A}}$g=(2$\sqrt{2}$r×10-10cm)3×ρg/cm3,故NA=$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$,
故答案为:$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、电负性、分子结构与性质、空间构型与杂化方式、等电子体、化学键、配合物、晶胞计算等,需要学生具备扎实的基础,注意同周期主族元素中第一电离能异常情况.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 对石油进行分馏可以得到许多苯的同系物 | |
| C. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的 | |
| D. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 |
| A. | 在高温条件下进行反应 | B. | 在有氧条件下进行反应 | ||
| C. | 按化学式计量投入原料 | D. | 隔绝氧气 |
| A. | 电池充电时,阴极发生还原反应生成Mo3S4 | |
| B. | 电池充电时,阳极反应为xMg-2xe-═xMg2+ | |
| C. | 电池放电时,Mg2+向负极迁移 | |
| D. | 电池放电时,正极反应为Mo3S4+2xe-+xMg2+═MgxMo3S4 |
| A. | 原子序数为24 | |
| B. | 最高价氧化物为SeO3,为酸性氧化物 | |
| C. | 原子半径比钙小 | |
| D. | 气态氢化物分子式为H2Se,性质不稳定 |
| A. | 混合气体中一定含有乙烯 | B. | 混合气体中一定含有甲烷 | ||
| C. | 混合气体中一定含有丙烯 | D. | 混合气体中可能含有乙烷 |
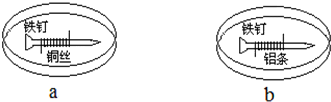
| A. | a中铁钉附近呈现红色 | B. | b中铁钉上发生还原反应 | ||
| C. | a中铜丝上发生还原反应 | D. | b铁钉上有气泡产生 |
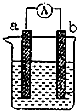 图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: