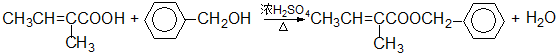题目内容
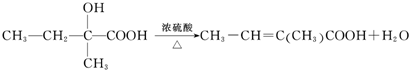
17.位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小.B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍.根据你的推断回答下列问题:写出由上述元素形成的具有漂白作用的四种物质的化学式SO2,O3,H2O2,Na2O2.
分析 短周期的四种元素A、B、C、D,它们的原子序数依次增大,A在周期表中原子半径最小,则A为氢元素,A、C位于同一主族,则C为钠元素,B、D的最外层电子数相等,即为同主族元素,且B、D的原子序数之和为A、C原子序数之和的两倍,则B为氧元素,D为硫元素,据此答题.
解答 解:短周期的四种元素A、B、C、D,它们的原子序数依次增大,A在周期表中原子半径最小,则A为氢元素,A、C位于同一主族,则C为钠元素,B、D的最外层电子数相等,即为同主族元素,且B、D的原子序数之和为A、C原子序数之和的两倍,则B为氧元素,D为硫元素,
在H、O、Na、S四种元素中,能形成漂白作用的物质有:SO2、H2O2、Na2O2、O3等,
故答案为:SO2、O3、H2O2、Na2O2.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对基础知识的理解掌握,题目难度中等,侧重于基础知识的综合应用能力的考查.

练习册系列答案
相关题目
5.面粉厂严禁烟火的主要原因( )
| A. | 防止火灾发生 | B. | 防止污染面粉 | ||
| C. | 吸烟有害健康 | D. | 面粉颗粒极易被引燃而发生爆炸 |
12.用一种试剂鉴别乙醇、苯、1-己烯、苯酚溶液,可选用的试剂是( )
| A. | 溴水 | B. | 氯化铁溶液 | C. | 高锰酸钾溶液 | D. | 四氯化碳 |
2.下列说法不正确的是( )
| A. | 石油的分馏可以得到烷烃、环烷烃、芳香烃等产品 | |
| B. | 将石油裂化、裂解,综合利用石油资源 | |
| C. | 有节制地开采煤、石油、天然气等矿物资源 | |
| D. | 用于奥运火炬的丙烷是一种清洁燃料 |
9.下列说法可以证明反应N2+3H2?2NH3已达到平衡状态的是( )
| A. | 消耗1mol N2的同时,生成2mol NH3 | |
| B. | N2、H2、NH3的反应速率比为1:3:2的状态 | |
| C. | 1mol N≡N键断裂的同时,有6mol N-H 键断裂 | |
| D. | N2和H2浓度相等的时候 |
7. 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:Mg>Al>Na(用相应的元素符号表示).A、D两种元素中,电负性A>D (填“>”或“<”)
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.(用M、r、ρ表示)
 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.(用M、r、ρ表示)
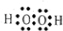
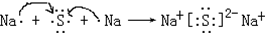
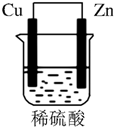 由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:
由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空: