题目内容
18.化学与社会、生活密切相关.下列说法正确的是( )| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 对石油进行分馏可以得到许多苯的同系物 | |
| C. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的 | |
| D. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 |
分析 A.常温下Fe与液氯不反应,Fe与浓硫酸发生钝化;
B.苯的同系物是主要由煤的干馏产生的;
C.汽车尾气中氮氧化物的产生是由于空气中的氮气与氧气在放电的时候生成的;
D.钠燃烧生成过氧化钠,过氧化钠与二氧化碳反应,电石能够与水反应生成乙炔;
解答 解;A.常温下Fe与液氯不反应,Fe与浓硫酸发生钝化,则用钢瓶储存液氯或浓硫酸,故A正确
B.苯的同系物是主要由煤的干馏产生的,对石油进行分馏主要得到饱和烷烃的各类烃的混合物,故B错误;
C.汽车尾气中氮氧化物的产生是由于空气中的氮气与氧气在放电的时候生成的,汽油中主要是烃,故C错误;
D.钠燃烧生成过氧化钠,过氧化钠与二氧化碳反应,电石能够与水反应生成乙炔,乙炔为可燃气,氧气为助燃气体,则钠起火不能用泡沫灭火器将火扑灭,故D错误;
故选:A.
点评 本题考查了化学知识在生产和生活中的运用,涉及试剂的保存,煤、石油的加工及产品,钠、电石等的性质,题目难度不大.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
9.下列说法可以证明反应N2+3H2?2NH3已达到平衡状态的是( )
| A. | 消耗1mol N2的同时,生成2mol NH3 | |
| B. | N2、H2、NH3的反应速率比为1:3:2的状态 | |
| C. | 1mol N≡N键断裂的同时,有6mol N-H 键断裂 | |
| D. | N2和H2浓度相等的时候 |
10.镁电池毒性低、污染小,电压高且平稳,它逐渐成为人们研究绿色电池的关注焦点.其中一种镁电池的反应原理为:xMg+Mo3S4 $?_{充电}^{放电}$MgxMo3S4,下列说法正确的是( )
| A. | 放电时Mo3S4发生氧化反应 | |
| B. | 放电时,正极反应式为:Mo3S4+2xe-=Mo3S42x- | |
| C. | 充电时,电路中通过2mol电子时,可消耗1mol Mg | |
| D. | 充电时,Mg2+向负极移动 |
7. 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:Mg>Al>Na(用相应的元素符号表示).A、D两种元素中,电负性A>D (填“>”或“<”)
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
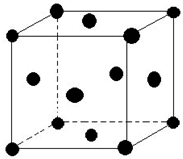
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.(用M、r、ρ表示)
 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.(用M、r、ρ表示)
8.下列说法不正确的是( )
| A. | 空气的首要污染物包括CO2、SO2、NO、NO2、O3等 | |
| B. | PM2.5指的是直径为2.5微米的可吸入颗粒物,因其直径小、比表面积大、活性强、易吸附有毒有害的物质,对人的健康和大气环境质量的影响较大 | |
| C. | 光化学烟雾的形成与氮氧化物有关 | |
| D. | SO2的治理技术和设备有:原煤脱硫技术、改进燃烧技术和烟气脱硫设备等 |
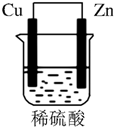 由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:
由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:
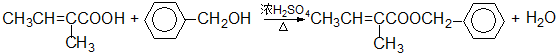
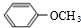
 .
.
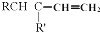
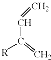 +
+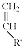 $\stackrel{△}{→}$
$\stackrel{△}{→}$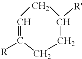
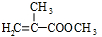 .
.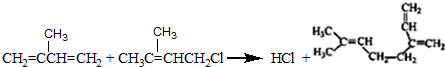 .
.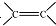 和
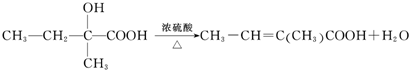
和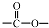 结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式
结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式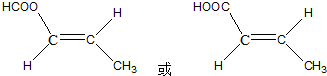 .
.