题目内容
12.目前含有元素硒(Se)的保健品已开始涌入市场,已知它与氧同主族,而与钙同周期,下列关于硒的有关描述中不正确的是( )| A. | 原子序数为24 | |
| B. | 最高价氧化物为SeO3,为酸性氧化物 | |
| C. | 原子半径比钙小 | |
| D. | 气态氢化物分子式为H2Se,性质不稳定 |
分析 元素硒(Se)与氧同主族,而与钙同周期,则位于第四周期第ⅥA族,结合同主族元素及化合物的性质来解答.
解答 解:A.Se原子序数为8+8+18=34,故A错误;
B.位于ⅥA族,最高价为+6价,则最高价氧化物为SeO3,为酸性氧化物,故B正确;
C.同周期从左向右原子半径减小,则Se的原子半径比钙小,故C正确;
D.最低价为-2价,同主族非金属性从上到下减弱,则气态氢化物分子式为H2Se,性质不稳定,故D正确;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、元素的性质为解答的关键,侧重分析与应用能力的考查,注意同主族元素性质变化规律,题目难度不大.

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
2.下列说法不正确的是( )
| A. | 石油的分馏可以得到烷烃、环烷烃、芳香烃等产品 | |
| B. | 将石油裂化、裂解,综合利用石油资源 | |
| C. | 有节制地开采煤、石油、天然气等矿物资源 | |
| D. | 用于奥运火炬的丙烷是一种清洁燃料 |
20.下列叙述都涉及有机化学相关知识,其中正确的是( )
| A. | 烧菜时加少量的醋和料酒会使菜味清香可口,是因为醋酸和酒精都具有香味 | |
| B. | 氯化汞(HgCl2)的稀溶液可用于手术器械消毒,因为它会使蛋白质变性,杀菌消毒 | |
| C. | 一定条件下,稻草可制得酒精和氨基酸 | |
| D. | 氟利昂(CF2Cl2)会破坏大气臭氧层,从而导致“温室效应” |
7. 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:Mg>Al>Na(用相应的元素符号表示).A、D两种元素中,电负性A>D (填“>”或“<”)
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
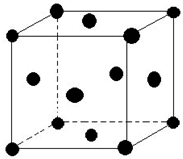
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.(用M、r、ρ表示)
 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.(用M、r、ρ表示)
17.下列物质一定表示一种纯净物的是( )
| A. | C5H12 | B. | C4H10 | C. | 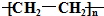 | D. | CHCl3 |
1.用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:
Pb+PbO2+4HBF4$?_{放电}^{充电}$2Pb(BF4)2+2H2O;
Pb(BF4)2为可溶于水的强电解质,下列说法正确的是( )
Pb+PbO2+4HBF4$?_{放电}^{充电}$2Pb(BF4)2+2H2O;
Pb(BF4)2为可溶于水的强电解质,下列说法正确的是( )
| A. | 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O | |
| B. | 充电时,当阳极质量增加23.9 g时,溶液中有0.2 mol电子通过 | |
| C. | 放电时,正极区pH增大 | |
| D. | 充电时,Pb电极与电源的正极相连 |

 +
+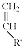 $\stackrel{△}{→}$
$\stackrel{△}{→}$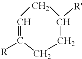
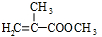 .
.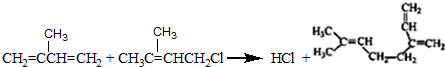 .
.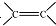 和
和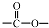 结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式
结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式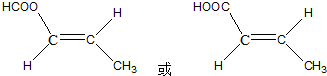 .
. 用系统命名法命名该烃:2,3-二甲基戊烷.
用系统命名法命名该烃:2,3-二甲基戊烷.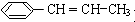 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: .
. .
.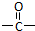 ”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.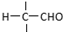 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$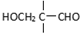
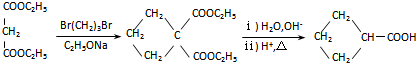
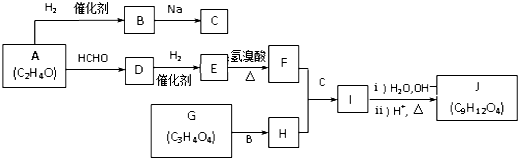
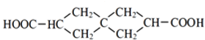 .J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.写出符合上述所有条件的X的一种结构简式
.J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.写出符合上述所有条件的X的一种结构简式 .
.