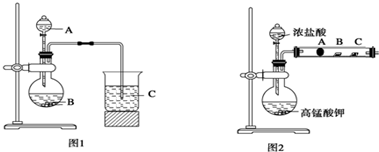
题目内容
15.碳化钛(TiC)、碳化硼(B4C3)、氮化硅(Si3N4)和碳化硅(SiC)等非氧化物陶瓷是新型无机非金属材料,有关制备这些物质的条件选择正确的是( )| A. | 在高温条件下进行反应 | B. | 在有氧条件下进行反应 | ||
| C. | 按化学式计量投入原料 | D. | 隔绝氧气 |
分析 A.依据原子晶体熔点高特点解答;
B.高温下C、N、B、Si、Ti都能与氧气反应;
C.依据原子晶体结构特点;
D.高温下C、N、B、Si、Ti都能与氧气反应,制备时应在隔绝氧气条件下进行.
解答 解:A.碳化钛(TiC)、碳化硼(B4C3)、氮化硅(Si3N4)和碳化硅(SiC)是原子晶体,熔点高,所以合成时需要在高温下进行,故A正确;
B.高温下C、N、B、Si、Ti都能与氧气反应,所以应在无氧的条件下进行,故B错误;
C.原子晶体是原子按照一定比例结合而成,所以合成时应按化学式计量投入原料,故C正确;
D.高温下C、N、B、Si、Ti都能与氧气反应,所以应在隔绝氧气条件下进行,故D正确;
故选:ACD.
点评 本题考查了化学反应条件的选择,明确晶体类型及特点、性质是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.面粉厂严禁烟火的主要原因( )
| A. | 防止火灾发生 | B. | 防止污染面粉 | ||
| C. | 吸烟有害健康 | D. | 面粉颗粒极易被引燃而发生爆炸 |
10.镁电池毒性低、污染小,电压高且平稳,它逐渐成为人们研究绿色电池的关注焦点.其中一种镁电池的反应原理为:xMg+Mo3S4 $?_{充电}^{放电}$MgxMo3S4,下列说法正确的是( )
| A. | 放电时Mo3S4发生氧化反应 | |
| B. | 放电时,正极反应式为:Mo3S4+2xe-=Mo3S42x- | |
| C. | 充电时,电路中通过2mol电子时,可消耗1mol Mg | |
| D. | 充电时,Mg2+向负极移动 |
20.下列叙述都涉及有机化学相关知识,其中正确的是( )
| A. | 烧菜时加少量的醋和料酒会使菜味清香可口,是因为醋酸和酒精都具有香味 | |
| B. | 氯化汞(HgCl2)的稀溶液可用于手术器械消毒,因为它会使蛋白质变性,杀菌消毒 | |
| C. | 一定条件下,稻草可制得酒精和氨基酸 | |
| D. | 氟利昂(CF2Cl2)会破坏大气臭氧层,从而导致“温室效应” |
7. 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:Mg>Al>Na(用相应的元素符号表示).A、D两种元素中,电负性A>D (填“>”或“<”)
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.(用M、r、ρ表示)
 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.(用M、r、ρ表示)

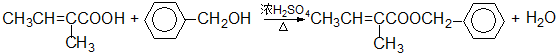
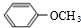

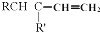
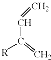 +
+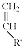 $\stackrel{△}{→}$
$\stackrel{△}{→}$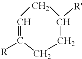
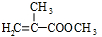 .
.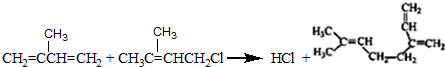 .
.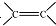 和
和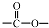 结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式
结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式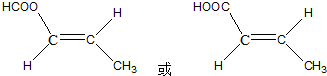 .
. 用系统命名法命名该烃:2,3-二甲基戊烷.
用系统命名法命名该烃:2,3-二甲基戊烷.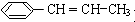 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: .
. .
.