题目内容
19.两种气态烃的混合物共2.24L(标准状况),完全燃烧后得3.36L〔标准状况)二氧化碳和3.6g的水,下列说法中正确的是( )| A. | 混合气体中一定含有乙烯 | B. | 混合气体中一定含有甲烷 | ||
| C. | 混合气体中一定含有丙烯 | D. | 混合气体中可能含有乙烷 |
分析 根据n=$\frac{m}{M}$计算3.6g水的物质的量,根据n=$\frac{V}{{V}_{m}}$计算混合烃、二氧化碳的物质的量,根据H原子、C原子守恒计算混合物的平均分子组成,然后对各选项进行判断.
解答 解:标准状况下2.24L混合烃的物质的量为:n=$\frac{22.4L}{22.4L/mol}$=0.1mol,
3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,平均分子式中含有的H原子数目为:$\frac{0.2mol×2}{0.1mol}$=4,
3.36L二氧化碳的物质的量为:n=$\frac{3.36L}{22.4L/mol}$=0.15mol,平均分子式中含有的C原子数目为:$\frac{0.15mol}{0.1mol}$=1.5,
则该混合烃的平均分子式为:C1.5H4,
根据C原子可知,烃中碳原子数小于1的只有甲烷,则该烃中一定含有CH4;甲烷分子中含有4个H原子,而平均分子式中H原子数为4,则另一烃的分子中H原子数目为4,
A.根据分析可知,该混合气体中一定含有甲烷,可能含有乙烯,但不一定含有乙烯,故A错误;
B.混合气体中一定含有甲烷,故B正确;
C.丙烯分子中含有6个H,则混合气体中一定不含丙烯,故C错误;
D.乙烷分子中含有6个H,则混合气体中一定不含乙烷,故D错误;
故选B.
点评 本题考查了有机物分子式确定的计算,题目难度中等,根据题中数据确定该混合气体的平均分子式为解答关键,注意掌握平均值法在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
9.下列说法可以证明反应N2+3H2?2NH3已达到平衡状态的是( )
| A. | 消耗1mol N2的同时,生成2mol NH3 | |
| B. | N2、H2、NH3的反应速率比为1:3:2的状态 | |
| C. | 1mol N≡N键断裂的同时,有6mol N-H 键断裂 | |
| D. | N2和H2浓度相等的时候 |
10.镁电池毒性低、污染小,电压高且平稳,它逐渐成为人们研究绿色电池的关注焦点.其中一种镁电池的反应原理为:xMg+Mo3S4 $?_{充电}^{放电}$MgxMo3S4,下列说法正确的是( )
| A. | 放电时Mo3S4发生氧化反应 | |
| B. | 放电时,正极反应式为:Mo3S4+2xe-=Mo3S42x- | |
| C. | 充电时,电路中通过2mol电子时,可消耗1mol Mg | |
| D. | 充电时,Mg2+向负极移动 |
7. 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:Mg>Al>Na(用相应的元素符号表示).A、D两种元素中,电负性A>D (填“>”或“<”)
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
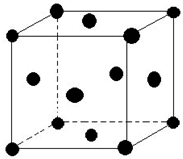
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.(用M、r、ρ表示)
 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,
C7H15OH 中采用sp3杂化的原子共有8个;
(4)E(NH3)42+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则 E(NH3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式$\frac{\sqrt{2}×1{0}^{30}M}{8ρ{r}^{3}}$.(用M、r、ρ表示)
11.可能在有机物的分子中引入羟基官能团的反应类型有:①氧化反应②取代反应 ③消去反应 ④加成反应 ⑤水解反应.其中正确的组合有( )
| A. | ①②③ | B. | ②③⑤ | C. | ②④⑤ | D. | ②③④⑤ |
8.下列说法不正确的是( )
| A. | 空气的首要污染物包括CO2、SO2、NO、NO2、O3等 | |
| B. | PM2.5指的是直径为2.5微米的可吸入颗粒物,因其直径小、比表面积大、活性强、易吸附有毒有害的物质,对人的健康和大气环境质量的影响较大 | |
| C. | 光化学烟雾的形成与氮氧化物有关 | |
| D. | SO2的治理技术和设备有:原煤脱硫技术、改进燃烧技术和烟气脱硫设备等 |
9.5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6mol•L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断A、C的化学式为:ACuSO4;CBa(OH)2.
(2)写出步骤②中发生反应的离子方程式2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑.
(3)D溶液中滴入石蕊试液,现象是溶液由无色变成红色,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式说明).
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是500mL.
| 阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
| 阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6mol•L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断A、C的化学式为:ACuSO4;CBa(OH)2.
(2)写出步骤②中发生反应的离子方程式2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑.
(3)D溶液中滴入石蕊试液,现象是溶液由无色变成红色,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式说明).
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是500mL.
 HClO
HClO
 Mg
Mg .
. 用系统命名法命名该烃:2,3-二甲基戊烷.
用系统命名法命名该烃:2,3-二甲基戊烷.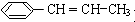 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: .
. .
.