题目内容
18.某无色溶液由Na+、Ag+、Ba2+、Al3+、-、CO32-、SO32-、SO42-、MnO4-中的若干种组成,取该溶液进行如下实验:(已知:Al3++3HCO3-=Al(OH)3↓+3CO2↑)
①取适量试液,加入过量盐酸,有无色无味气体生成,并得到溶液.
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲.
③在②所得溶液中加入过量氢氧化钡溶液,也有气体生成,并有白色沉淀乙析出.
根据上述现象,回答下列问题:
(1)溶液中一定存在的离子是CO32-、Na+、AlO2-;
(2)溶液中一定不存在的离子是MnO4-、Ag+、Ba2+、Al3+;
(3)证明白色沉淀甲是两性氢氧化物的有关离子方程式是Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═AlO2-+2H2O.
(4)判断沉淀乙组成的实验方法是取少量沉淀乙置于试管中,加入足量盐酸,若沉淀全部溶解,则沉淀乙为BaCO3;若沉淀不完全溶解,则沉淀乙为BaCO3和BaSO4.
分析 溶液无色,一定没有高锰酸根离子,
①能够与盐酸生成气体的离子为碳酸根离子,能够与碳酸根离子反应的离子不能存在;
②说明发生了双水解,一定存在与碳酸氢根离子发生双水解的离子;
③气体乙为氨气,白色沉淀为碳酸钡或硫酸钡,据此进行推断.
解答 解:某无色溶液,说明溶液中一定不会存在高锰酸根离子,
①加入过量盐酸,有气体生成,并得到无色溶液,生成的气体甲为二氧化碳,所以溶液中一定存在CO32-,一定不存在SO32-、Ag+、Ba2+、Al3+,阳离子只剩下了钠离子,根据溶液一定呈电中性可知溶液中一定存在Na+;
②在A所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲,白色沉淀甲为氢氧化铝,原溶液中一定存在AlO2-,
③在B所得溶液中加入过量Ba(OH)2溶液,也有气体生成,同时析出白色沉淀乙,白色沉淀一定含有碳酸钡,可能含有硫酸钡;
(1)由以上分析可知溶液中一定存在的离子有:CO32-、Na+、AlO2-,故答案为:CO32-、Na+、AlO2-;
(2)由以上分析可知溶液中一定不存在MnO4-、Ag+、Ba2+、Al3+,
故答案为:MnO4-、Ag+、Ba2+、Al3+;
(3)白色沉淀甲为氢氧化铝,属于两性氢氧化物,既能和强酸反应又能和强碱反应,即Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═-+2H2O,
故答案为:Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═AlO2-+2H2O;
(4)白色沉淀乙一定含有碳酸钡,可能含有硫酸钡,可加入盐酸检验,如沉淀部分溶解,则含有碳酸钡和硫酸钡,如沉淀全部溶解,则只含碳酸钡,
故答案为:取少量沉淀乙置于试管中,加入足量盐酸,若沉淀全部溶解,则沉淀乙为BaCO3;若沉淀不完全溶解,则沉淀乙为BaCO3和BaSO4.
点评 本题考查了常见离子的检验方法,题目难度不大,注意根据溶液呈电中性判断溶液中存在的离子方法,本题充分考查了学生的分析、理解能力,要求熟练掌握常见离子的检验方法.

| A. | 2mol/L NaOH溶液 | B. | 2mol/LH2SO4溶液 | C. | 2mol/LMgSO4溶液 | D. | FeCl3溶液 |
| A. | 制造普通玻璃的主要原料是纯碱、石灰石和石英 | |
| B. | 盛放烧碱溶液的试剂瓶不能用玻璃塞 | |
| C. | 玻璃在加热熔化时有固定的熔点 | |
| D. | 普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅 |
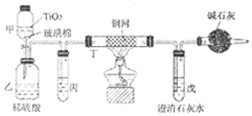
(1)NaCN的电子式为Na+
 .
.(2)甲中反应的化学方程式为NaCN+NaClO=NaCNO+NaCl,乙中反应的离子方程式为2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O、2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O.
(3)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,丙中加入饱和食盐水,则装置的作用为除去氯气中的氯化氢.
(4)设计一个确定CN-被处理的百分率的实验方案过滤、洗涤、干燥、称量戊中沉淀的质量,计算出CN-被处理的百分率,装有碱石灰的干燥管的作用是防止空气中的二氧化碳进入戊装置影响沉淀测定的准确度.
(5)氢氰酸(HCN)是现代最早广泛使用的熏蒸之一,可以用于防治各种仓储害虫.在含有NaCN的废液中通入CO2可以制备氢氰酸.己知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |

| A. | a电极是该电池的负极,发生氧化反应 | |
| B. | b电极反应式为2NO3-+10e-+12H+═N2↑+6H2O | |
| C. | 电池工作时,H+由左室通过质子交换膜进入右室 | |
| D. | 转化室中发生反应后溶液的pH增大(忽略体积变化) |
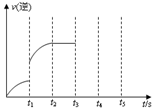 一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:$K=\frac{{c(CO)•c({H_2})}}{{c({H_2}O)}}$
一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:$K=\frac{{c(CO)•c({H_2})}}{{c({H_2}O)}}$