题目内容
3.氰化物广泛应用于冶金、化工、医药等行业,因其对人畜及环境的巨大危害,需对含氰化物的废液进行深度处理.如处理含有NaCN的废液时,可在催化剂TiO2作用下,先用NaC1O将NaCN 氧化成NaCNO,再在酸性条件下继续被NaClO氧化,生成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性.将含一定量NaCN的污水浓缩后与过量NaClO溶液混合倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.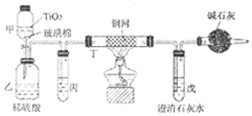
(1)NaCN的电子式为Na+
 .
.(2)甲中反应的化学方程式为NaCN+NaClO=NaCNO+NaCl,乙中反应的离子方程式为2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O、2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O.
(3)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,丙中加入饱和食盐水,则装置的作用为除去氯气中的氯化氢.
(4)设计一个确定CN-被处理的百分率的实验方案过滤、洗涤、干燥、称量戊中沉淀的质量,计算出CN-被处理的百分率,装有碱石灰的干燥管的作用是防止空气中的二氧化碳进入戊装置影响沉淀测定的准确度.
(5)氢氰酸(HCN)是现代最早广泛使用的熏蒸之一,可以用于防治各种仓储害虫.在含有NaCN的废液中通入CO2可以制备氢氰酸.己知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
分析 处理含有NaCN的废液流程:实验原理为测量戊装置中澄清石灰水吸收的二氧化碳的质量确定对CN-的处理,由于乙装置中产生N2、CO2、Cl2、H2O,氯气、氯化氢都能被石灰水吸收,影响二氧化碳质量的测定,所以进入戊装置的气体应除去氯气、氯化氢,用丙装置:饱和食盐水吸氯化氢,用丁装置:用铜网除去氯气;碱石灰防止空气中的CO2、水蒸气进入戊装置干扰实验,影响二氧化碳质量的测定.
(1)NaCN为离子化合物,由钠离子和氰离子构成,据此书写电子式;
(2)甲装置中,在催化剂TiO2作用下,先用NaC1O将NaCN 氧化成NaCNO,根据题意可知,乙装置中酸性条件下CNO-与NaClO反应生成N2、CO2和Cl-,或生成N2、CO2和Cl2,根据得失电子守恒和电荷守恒配平;
(3)测量戊装置中澄清石灰水吸收的二氧化碳的质量确定对CN-的处理,氯气能被石灰水吸收,氯气难溶于饱和食盐水,HCl极易溶于水;
(4)为测量戊装置中澄清石灰水吸收的二氧化碳的质量确定对CN-的处理,根据碳原子守恒,计算出被处理的CN-的物质的量,所以过滤、洗涤、干燥、称量戊中沉淀的质量,计算出CN-被处理的百分率;碱石灰作用是防止空气中的二氧化碳进入装置戊中影响沉淀测定的准确度;
(5)根据酸的电离常数进行分析判断,电离常数越大,酸性越强,向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳.
解答 解:(1)NaCN为离子化合物,由Na+和CN-构成,电子式为:Na+ ,
,
故答案为:Na+ ;
;
(2)甲装置中,在催化剂TiO2作用下,先用NaC1O将NaCN 氧化成NaCNO,反应为:NaCN+NaClO=NaCNO+NaCl,乙装置中酸性条件下CNO-与NaClO反应生成N2、CO2和Cl-,或生成N2、CO2和Cl2,反应离子方程式为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O、2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
故答案为:NaCN+NaClO=NaCNO+NaCl;2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O、2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
(3)氯气难溶于饱和食盐水,但HCl极易溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体,
故答案为:除去氯气中的氯化氢;
(4)为测量戊装置中澄清石灰水吸收的二氧化碳的质量确定对CN-的处理,由于乙装置中产生N2、CO2、Cl2、H2O,氯气、氯化氢都能被石灰水吸收,影响二氧化碳质量的测定,所以进入戊装置的气体应除去氯气、氯化氢,用丙装置:饱和食盐水吸氯化氢,用丁装置:用铜网除去氯气;碱石灰防止空气中的CO2、水蒸气进入戊装置干扰实验,影响二氧化碳质量的测定,所以确定CN-被处理的百分率的实验方案为过滤、洗涤、干燥、称量戊中沉淀的质量,计算出CN-被处理的百分率,装有碱石灰的干燥管的作用是防止空气中的二氧化碳进入戊装置影响沉淀测定的准确度,
故答案为:过滤、洗涤、干燥、称量戊中沉淀的质量,计算出CN-被处理的百分率;防止空气中的二氧化碳进入戊装置影响沉淀测定的准确度;
(5)根据图表数据分析,电离常数:H2CO3>HCN>碳酸氢根离子,酸性:H2CO3>HCN>HCO3-,向NaCN溶液中通入少量CO2,由于故反应生成HCN和碳酸氢钠,不能生成二氧化碳,则反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3,
故答案为:NaCN+H2O+CO2=HCN+NaHCO3.
点评 本题考查物质组成与含量的测定、对实验原理与装置理解与评价、阅读获取信息的能力等,题目难度中等,是对知识的综合运用,理解实验原理是解题的关键,试题培养了学生的灵活应用能力.

 名校课堂系列答案
名校课堂系列答案
下列说法正确的是( )
| A. | 元素C、D形成的简单离子半径,前者大于后者 | |
| B. | F的热稳定性比H2S弱 | |
| C. | 化合物A、F中化学键的类型相同 | |
| D. | 元素C、D的最高价氧化物的水化物均可以和H发生反应 |
 短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )
短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 最高价氧化物对应水化物的酸性:M>Z | |
| D. | 由R、X、Y、M四种元素只能组成一种盐 |
| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,30g丙醇中存在的共价键总数为5NA | |
| C. | 2 mol Cu和足量热浓硫酸反应可生成2NA个SO3分子 | |
| D. | 电解法精炼铜时,若转移的电子数为NA个,则阳极质量减小32g |

 过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(OCN)64-等.
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(OCN)64-等. Mg2FeH6+Mg.
Mg2FeH6+Mg.