题目内容
3. 一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:$K=\frac{{c(CO)•c({H_2})}}{{c({H_2}O)}}$
一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:$K=\frac{{c(CO)•c({H_2})}}{{c({H_2}O)}}$(1)请写出该反应的化学方程式:C(s)+H2O(g)?CO(g)+H2(g).
(2)恒温恒容条件下容器中气体的平均相对分子质量、气体的分子总数或混合气体的压强或密度不再随时间变化,都可说明该反应已达平衡状态.
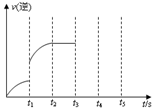
(3)该反应的逆反应速率随时间变化的关系如图,t1时的突变一定是因为某种条件的改变,该改变不可能是ab;
a.减小H2浓度b.使用催化剂c.升高温度.
分析 (1)根据化学平衡常数表达式知,生成物是CO和氢气,反应物有水,根据元素守恒知,反应物还含有C;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(3)改变条件时逆反应速率增大,随着反应的进行,逆反应速率逐渐增大,说明平衡正向移动.
解答 解:(1)根据化学平衡常数表达式知,生成物是CO和氢气,反应物有水,根据元素守恒知,反应物还含有C,所以该可逆反应为C(s)+H2O(g)?CO(g)+H2(g),故答案为:C(s)+H2O(g)?CO(g)+H2(g);
(2)该反应前后气体计量数之和增大,所以恒温恒容条件下容器中气体的平均相对分子质量、气体的分子总数或混合气体的压强、密度都改变,当这些量不再随时间变化时该反应达到平衡状态,
故答案为:压强或密度;
(3)改变条件时逆反应速率突然增大,随着反应的进行,逆反应速率增大,说明平衡正向移动,
a.减小H2浓度,逆反应速率减小,故a选;
b.使用催化剂,逆反应速率增大,但是平衡不移动,故b选;
c.碳与水蒸气的反应属于吸热反应,升高温度,正向移动,正逆反应速率都增大,故c不选;
故答案为:ab.
点评 本题考查化学平衡图象分析、化学平衡状态的判断,明确化学平衡状态的判断方法和外界条件对反应速率、化学平衡的影响是解本题关键,会根据图象曲线变化确定反应方向,题目难度中等.

练习册系列答案
相关题目
18.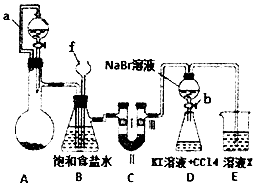 实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:
实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:
(1)仪器f的名称长颈漏斗.
(2)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr207),还原产物是CrCi3,写出A中离子方程式:Cr2O72-+l4H++6Cl-═2Cr3++3C12↑+7H2O.
(3)B装置的作用除了用来除去氯气中的氯化氢外还有作安全瓶,检测实验过程中装置是否堵塞.
(4)装置C的作用是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是③(填序号)
(5)利用D装置证明溴的非金属性比碘强的实验操作是:实验完毕,打开活塞b,使少量液体流入锥形瓶,关闭活塞b,振荡锥形瓶,现象是静罝分层,下层液体呈紫红色.(补充完整上述实验操作和现象)
(6)D装置进行实验时存在的明显不足是没有排除氯气对溴单质与KI反应的干扰.
 实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:
实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:(1)仪器f的名称长颈漏斗.
(2)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr207),还原产物是CrCi3,写出A中离子方程式:Cr2O72-+l4H++6Cl-═2Cr3++3C12↑+7H2O.
(3)B装置的作用除了用来除去氯气中的氯化氢外还有作安全瓶,检测实验过程中装置是否堵塞.
(4)装置C的作用是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是③(填序号)
| ① | ② | ③ | ④ | |
| I | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| II | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| II! | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 |
(6)D装置进行实验时存在的明显不足是没有排除氯气对溴单质与KI反应的干扰.
15.下列说法正确的是( )
| A. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| B. | 检验铵盐方法:加氢氧化钠溶液,加热,用蘸有浓硫酸的玻璃棒靠近瓶口 | |
| C. | .制取硝酸铝方法:用AlCl3溶液和氨水反应,过滤得沉淀,再加稀HNO3 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,后者放出的CO2多 |
12.下列化学用语表示正确的是( )
| A. | 氯化铵的电子式: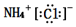 | B. | 中子数为18的硫原子:${\;}_{16}^{18}$S | ||
| C. | 水分子的球棍模型: | D. | 乙烯的结构简式:CH2=CH2 |
 ;A、C、D形成的化合物
;A、C、D形成的化合物 .
. .
. 过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(OCN)64-等.
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(OCN)64-等. Mg2FeH6+Mg.
Mg2FeH6+Mg.


