题目内容
20.某化学科研小组对周围大气进行监测,发现该地区首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx灯进行研究具有重要意义.请回答下列问题:(1)将PM2.5样品配成待测试样,若测得该试样所含水溶性无机离子的化学组分及平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2))①为减少SO2的排放,可洗涤含SO2的烟气,作为洗涤剂下列物质最好选择a(填字母).
a.氨水 b.Na2CO3 c.O2 d.NaHSO3
②浓度均为0.1mol/L(NH4)2Fe(SO4)2、NH4HSO4、(NH4)2SO3,其中c(NH4+)最大的是(NH4)2Fe(SO4)2(填化学式).
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,试判断该设想能否实现并简述理由否,因△H>0且△S<0,则在任何温度下△G>0,不可能自发进行.
分析 (1)先根据溶液中电荷守恒计算氢离子的浓度,然后求出pH;
(2)①二氧化硫使酸性氧化物和碱或碱性盐溶液反应;
②物质的量浓度相等的这几种溶液中,NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),铵根离子水解程度较小,所以要比较铵根离子浓度大小,先比较盐中铵根离子的系数,系数越大,溶液中铵根离子浓度越大,相同系数的铵盐溶液,再根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可;
(3)①依据化学反应速率和平衡移动原理分析判断;
②根据G=△H-T•△S判断反应能否自发进行.
解答 解:(1)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性;试样的pH值根据溶液中电荷守恒:c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-)计算H+离子浓度为10-4,该样本的pH=4,
故答案为:4;
(2)洗涤含SO2的烟气,根据酸性氧化物的性质可选a.氨水 b.Na2CO3,而氯化钙和亚硫酸氢钠不与二氧化硫反应,碳酸钠碱性较弱,最好选用氨水,
故答案为:a;
②(NH4)2Fe(SO4)2、(NH4)2SO3中铵根离子系数是2,NH4HSO4中铵根离子系数都是1,所以(NH4)2Fe(SO4)2、(NH4)2SO3比NH4HSO4的大,(NH4)2Fe(SO4)2中二价铁离子抑制铵根离子水解,浓度最大,
故答案为:(NH4)2Fe(SO4)2;
(3)①气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
故答案为:吸热反应,温度升高,平衡正向移动,NO的含量增大;
②2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T•△S,G>0,不能实现,
故答案为:否,因△H>0且△S<0,则在任何温度下△G>0,不可能自发进行.
点评 该题考查较为综合,涉及离子的水解、pH值的计算、化学平衡常数的计算、自由能的应用等知识,题目难度中等,明确反应能够自发进行的条件为解答关键,注意掌握溶液酸碱性与溶液pH的关系.

| A. | 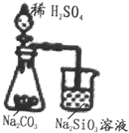 可以用业证明非金属性的相对强弱S>C>Si 可以用业证明非金属性的相对强弱S>C>Si | |
| B. | 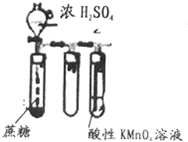 可以用来检验是否有还原性气体生成 可以用来检验是否有还原性气体生成 | |
| C. | 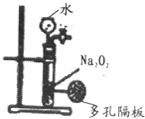 该装置可以用业制备少量氧气,且可以控制反应的进行及快慢 该装置可以用业制备少量氧气,且可以控制反应的进行及快慢 | |
| D. |  滴定过程中褪色速度由慢到快又减慢,达到终点时,溶液的颜色从无色突变为浅紫红色 滴定过程中褪色速度由慢到快又减慢,达到终点时,溶液的颜色从无色突变为浅紫红色 |
| A. | 原混合气为体积比为1:2的乙烯和乙炔 | |
| B. | 原混合气为体积比为1:1的丙烯和丙炔 | |
| C. | 原混合气为任意体积比的乙烯和乙炔 | |
| D. | 原混合气为体积比为1:2的乙烯和丙炔 |
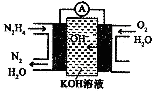 肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:(1)肼是火箭的高能燃料,该物质燃烧时生成水蒸气和氮气,已知某些化学键能如下:
| 化学键 | O-H | N-N | N-H | O=O | N═N |
| 键能/KJ•mol-1 | 467 | 160 | 391 | 498 | 945 |
②气态N2H4在氧气中燃烧的热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=一591kJ/mol.
(2)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液,该反应的离子方程式为ClO-+2NH3=N2H4+Cl-+H2O.
(3)肼燃料电池原理如图所示,左边电极上发生反应的电极反应式为:N2H4-4e-+4OH-=N2+4H2O.
(4)盐酸肼(N2H6Cl2)是一种化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4 Cl类似,但分步水解.
①写出盐酸肼第一步水解的离子方程式N2H62++H2O═[N2H5•H2O]++H+.
②盐酸肼水溶液中离子浓度的关系为B (填序号).
A.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
B.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
C. c(N2H62+)+c([N2H5•H2O+])+c(H+)=c(Cl-)+c(OH-)
(5〕常温下,将0.2mol/L盐酸与0.2mol/L肼的溶液等体积混合(忽略混合后溶液体积变化〕.若测定混合液的pH=6,混合液中水电离出的H+与0.1mol/L盐酸中水电离出的H+浓度之比为107:1.
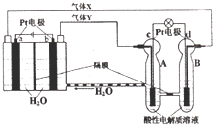
| A. | 有0.1mol电子转移时,a电极产生1.12LO2 | |
| B. | c极上发生还原反应,B中的H+可以通过隔膜进入A | |
| C. | b极上发生的电极反应是:4H2O+4e-=2H2↑+4OH- | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |

| A. | 苯环上的一氯代物种数相同 | |
| B. | 分子中共面的碳原子数一定相同 | |
| C. | 1 mol甲与浓溴水反应最多能消耗4 mol Br2 | |
| D. | 甲、乙可用红外光谱区分,但不能用核磁共振氢谱区分 |
 如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )| A. | Li 发生氧化反应,a 极为阴极 | |
| B. | 电子由 a 极流出通过电流表流入 b 极,然后再由 b 极经内电路回到 a 极 | |
| C. | 可以用水代替 SO(CH3)2做溶剂 | |
| D. | b 极反应式是 FeS2+4Li++4e-═Fe+2Li2S |
已知:①氧化性:IO3->Fe3+>I2;还原性:S2O32->I-;②KI+I2?KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有Fe2+(用离子符号表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O、2Fe3++2I-=2Fe2++I2.
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:O2+4KI+2H2O=2I2+4KOH.
将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质不适合作为食盐加碘剂,其理由是KI3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华.
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
| 0.01mol•L-1KIO3 酸性溶液(含淀粉) 的体积/mL | 0.01mol•L-Na2SO3 溶液的体积/mL | H2O的 体积/mL | 实验 温度 /℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t3 |