题目内容
向100mL 0.1mol? L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol ·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如右图所示。下列叙述正确的是
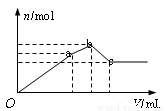
A.a点的沉淀总物质的量为0.03mol
B.oa段发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-= 2BaSO4↓+Al(OH)3↓;
C.ab段发生反应的离子方程式是:2NH4++SO42-+Ba2++2OH-=2NH3?H2O+ BaSO4↓
D.反应到c点时,加入Ba(OH)2溶液的总体积为250mL
CD
【解析】
试题分析:硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/LBa(OH)2溶液,在O——a段发生反应:Al2(SO4)3+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓;后在a—b段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+NH3?H2O,当物质反应完全后,再加Ba(OH)2溶液的b—c段发生反应:Ba(OH)2+2Al(OH)3 =Ba(AlO2)2+ 4H2O;当Al(OH)3溶解完全,沉淀达到最小值,此后再滴加也不能产生沉淀,沉淀也不再溶解。A.n(Al3+)=0.1mol,所以a点的沉淀总物质的量为0.01mol+0.015mol=0. 025mol ,错误;B.oa段发生反应就是硫酸铝与氢氧化钡的反应,离子方程式是:2Al3++3SO42-+3Ba2++6OH-= 3BaSO4↓+ 2Al(OH)3↓,错误;C.ab段发生的是硫酸铵与氢氧化钡的反应,反应的离子方程式是:2NH4++ SO42-+ Ba2++ 2OH-=2NH3?H2O+ BaSO4↓;正确;D.反应到c点时,加入的Ba(OH)2反应变为BaSO4、 Ba(AlO2)2。由于在原溶液中含有n(SO42-)=0.02mol;n(Al3+)=0.01mol,根据元素守恒可知消耗的Ba(OH)2的物质的量是0.02mol+0.01mol÷2=0.025mol。由于Ba(OH)2溶液的物质的量浓度是0.1mol/L,所以溶液的体积是V[Ba(OH)2]0.025mol÷0.1mol/L=0.25L= 250mL,正确。
考点:考查复盐溶液中加碱,发生反应的先后、离子方程式的书写、反应图像及溶液体积的计算的知识。

25℃时,0.1mol/L下列溶液的pH如下表,有关比较错误的是
序 号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸的强度:HF>H2CO3
B.由水电离产生的c(H+):①=②
C.溶液中离子的总浓度:①>③
D.④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3) 0.1 mol/L
0.1 mol/L

 (4)以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,该同学想在装置Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式 ,一段时间后,测得铁增重128g,此时b极通入气体的体积是 L(标准状况下)。
(4)以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,该同学想在装置Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式 ,一段时间后,测得铁增重128g,此时b极通入气体的体积是 L(标准状况下)。
