题目内容
关于下列装置的说法正确的是
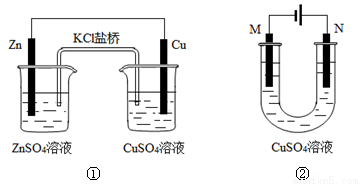
A.装置①中盐桥内的K+移向CuSO4溶液
B.装置①将电能转变为化学能
C.若装置②用于铁棒镀铜,则N极为铁棒
D.若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变
A
【解析】
试题分析:A、装置①中锌的金属线强于铜,锌是负极,铜是正极。原电池中阳离子向正极移动,则装置①中盐桥内的K+移向CuSO4溶液,A正确;B、原电池是把化学能转化为电能的装置,B错误;C、装置②是电解池,若用于铁棒镀铜,则镀层金属铜应该与电源的正极相连作阳极,即N极为铜,N极为铁棒,C错误;D、粗铜精炼时用于粗铜中含有杂质,开始时活泼的金属锌、铁等失去电子,而阴极始终是铜离子放电,所以若装置②用于电解精炼铜,溶液中的Cu2+浓度减小,D错误,答案选A。
考点:考查电化学原理的应用

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案(11分)电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为_________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是__________(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
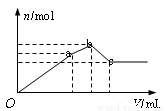
(2)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是_____(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____。
③V1和V2的关系:V1_____V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
①写出步骤2中溶液变红色的离子方程式__________________。
②步骤3中现象a是_____________________。
③用化学平衡原理解释步骤4的实验现象______________________。
 。则有机物
。则有机物 的二氯代物有
的二氯代物有 )的废水可以通过构成微生物电池除去,其原理如下图所示。
)的废水可以通过构成微生物电池除去,其原理如下图所示。