题目内容
20.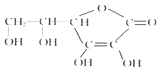 维生素C的结构简式如图所示:
维生素C的结构简式如图所示:(1)维生素C的分子式为C6H8O6.
(2)维生素C易溶于水(填“易”或“难”)
(3)维生素C能 使碘水褪色(填“能”或“不能”)说明维生素C有还原性.
(4)中学生每天需补充约60mg维生素C,下列物质中含有丰富维生素C的是A(填字母).
A.辣椒B.鸡蛋C.米饭D.青霉素.
分析 (1)由维生素C的结构简式可得分子式;
(2)维生素C属于水溶性维生素;
(3)维生素C具有较强的还原性,能被碘氧化;
(4)新鲜的水果、蔬菜中富含维生素C.
解答 解:(1)由维生素C的结构简式可得维生素C的分子式为C6H8O6,
故答案为:C6H8O6;
(2)维生素C属于水溶性维生素,因此维生素C易溶于水,不溶于有机溶剂,
故答案为:易;
(3)维生素C是一种抗氧化剂,具有较强的还原性,能被碘氧化,因此能使碘水褪色,
故答案为:能;还原;
(4)辣椒中富含维生素C,鸡蛋中富含蛋白质,米饭中富含糖类物质,青霉素不是人体中的营养物质,
故答案为:A.
点评 本题考查人体必需维生素的主要来源及摄入途径,题目难度不大,掌握维生素C的理化性质是解题的关键.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
6.一种三室微生物燃料电池污水净化系统原理如图所示,图中废水中有机物可用C6H10O5表示.下列有关说法正确的是( )


| A. | b电极为该电池的负极 | |
| B. | b电极附近溶液的pH减小 | |
| C. | a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | a交换膜为阳离子交换膜 |
11.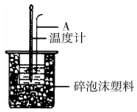 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-56.0kJ/mol
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是abc(填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的△H=-12.1kJ•mol-1;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ•mol-1.则CH3COOH在水溶液中电离的△H等于C
A.-67.7kJ•mol-1 B.-43.5kJ•mol-1C.+43.5kJ•mol-1 D.+67.7kJ•mol-1.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-56.0kJ/mol
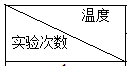 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的△H=-12.1kJ•mol-1;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ•mol-1.则CH3COOH在水溶液中电离的△H等于C
A.-67.7kJ•mol-1 B.-43.5kJ•mol-1C.+43.5kJ•mol-1 D.+67.7kJ•mol-1.
5.某芳香化合物的分子式为C8H10,且其一氯代物有2种,则该有机物的二氯代物有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
12.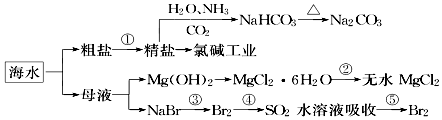 海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
 海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )| A. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 制取NaHCO3的反应是利用其溶解度相对较小 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
9.下列有关物质的分类正确的是( )
| A. | 混合物:水玻璃、碱石灰、明矾 | B. | 酸:稀硫酸、次氯酸、硫酸氢钠 | ||
| C. | 酸性氧化物:SO2、CO2、SiO2 | D. | 碱性氧化物:CaO、Na2O2、K2O |
3.铁元素是高中化学中重要的金属元素,也是日常生活中不可缺少的重要元素.在高中学习中了解了铁及其化合物的性质与用途.某中学化学兴趣小组对Fe2+与Fe3+有关性质非常感兴趣,做了如下实验.
(1)探究Fe2+与Fe3+性质
请你用离子方程式和必要的文字解释实验3现象的原因MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,Fe2+具有还原性,MnO4-被还原生成了无色的Mn2+.请你描述实验4中空格的实验现象是先生成白色沉淀,一会儿变成灰绿色,最后成红褐色沉淀.
(2)甲兴趣小组对0.1mol•L-1Fe2+与0.1mol•L-1Fe3+的鉴别做了如下实验,现象记录如下:
①根据上表信息,你可以得到结论是(任写两条):当浓度为0.1mol•L-1,上述四种溶液可以鉴别Fe2+、Fe3+、当浓度为0.01mol•L-1,只能用KSCN溶液、10%NaOH溶液来鉴别Fe2+、Fe3+;离子浓度不同,鉴别试剂的选择也不同.
②有同学认为,除了上述试剂可用来鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,还有一种更为简单方法,请猜测这位同学的方法是观察两种溶液的颜色,0.1mol•L-1Fe2+溶液为绿色,0.1mol•L-1Fe3+溶液为黄色.
(3)乙兴趣小组认为可以用KI淀粉试纸鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,请你简述操作方法取两片KI淀粉试纸放在表面皿上,用玻璃棒蘸取两种溶液滴在试纸中间,若试纸变蓝色为0.1mol•L-1Fe3+,但乙组在做此实验时,都失败了(试剂没有变质,也没有杂质).你认为失败的原因是KI溶液易被空气中的氧气氧化,生成I2,也使试纸变蓝.
(4)丙兴趣小组针对0.001mol•L-1Fe2+与0.001mol•L-1Fe3+无法用试剂来鉴别,他们想通过煮沸,蒸发溶剂,提高溶质的浓度来达到目的,你认为不行(行或不行)理由是在加热过程中Fe2+极易被空气中的氧气氧化为Fe3+.
(1)探究Fe2+与Fe3+性质
| 实验 序号 | 滴加试剂 | 0.1mol•L-1FeCl23mL | 0.1mol•L-1 FeCl3 mL |
| 1 | 滴入2滴KSCN溶液 | 溶液颜色无明显变化 | 溶液变为红色 |
| 2 | 滴入2滴苯酚溶液 | 溶液颜色无明显变化 | 溶液变为紫色 |
| 3 | 滴入2滴酸性的KMnO4溶液 | 溶液先变紫红后褪色 | 溶液变紫红色 |
| 4 | 滴入NaOH溶液 | 出现红棕色沉淀 |
(2)甲兴趣小组对0.1mol•L-1Fe2+与0.1mol•L-1Fe3+的鉴别做了如下实验,现象记录如下:
| 试剂 | KSCN溶液3滴 | 苯酚溶液2滴 | 0.01mol•L-KMnO4溶液3滴 | 10%NaOH溶液10滴 |
| 0.1mol•L-1FeCl3 | 深红色 | 紫色 | 黄色 | 红褐色沉淀 |
| 0.1mol•L-1FeCl2 | 无色 | 无色 | 无色 | 灰绿色沉淀 |
| 0.01mol•L-1FeCl3 | 红棕色 | 无色 | 几乎无色 | 淡黄色 |
| 0.01mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl3 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
②有同学认为,除了上述试剂可用来鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,还有一种更为简单方法,请猜测这位同学的方法是观察两种溶液的颜色,0.1mol•L-1Fe2+溶液为绿色,0.1mol•L-1Fe3+溶液为黄色.
(3)乙兴趣小组认为可以用KI淀粉试纸鉴别0.1mol•L-1Fe2+与0.1mol•L-1Fe3+,请你简述操作方法取两片KI淀粉试纸放在表面皿上,用玻璃棒蘸取两种溶液滴在试纸中间,若试纸变蓝色为0.1mol•L-1Fe3+,但乙组在做此实验时,都失败了(试剂没有变质,也没有杂质).你认为失败的原因是KI溶液易被空气中的氧气氧化,生成I2,也使试纸变蓝.
(4)丙兴趣小组针对0.001mol•L-1Fe2+与0.001mol•L-1Fe3+无法用试剂来鉴别,他们想通过煮沸,蒸发溶剂,提高溶质的浓度来达到目的,你认为不行(行或不行)理由是在加热过程中Fe2+极易被空气中的氧气氧化为Fe3+.