题目内容
6.一种三室微生物燃料电池污水净化系统原理如图所示,图中废水中有机物可用C6H10O5表示.下列有关说法正确的是( )
| A. | b电极为该电池的负极 | |
| B. | b电极附近溶液的pH减小 | |
| C. | a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | a交换膜为阳离子交换膜 |
分析 该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,以此解答该题.
解答 解:A.该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,故A错误;
B.右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,氢离子参加反应导致溶液酸性减小,溶液的pH增大,故B错误;
C.左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,故C正确;
D.放电时,电解质溶液中阳离子Na+移向正极右室,阴离子Cl-移向负极室左室,a不能为阳离子交换膜,故D错误.
故选C.
点评 本题考查化学电源新型电池,为高频考点,侧重考查学生获取信息、分析推断能力,根据N元素化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握.

练习册系列答案
相关题目
17.下列物质相互混合后,不会发生离子反应的是( )
| A. | Na2SO4溶液和MgCl2溶液 | B. | Na2CO3溶液和稀硫酸 | ||
| C. | NaOH溶液和Fe(SO4)3溶液 | D. | Ca(OH)2溶液和盐酸 |
14.化学与生产、生活、科技、环境等密切相关,下列说法不正确的是( )
| A. | 医用酒精的浓度通常是95% | |
| B. | “玉兔号”月球车太阳能电池帆板的材料含硅 | |
| C. | 小苏打和氢氧化铝胶囊,可以作内服药治疗胃酸过多 | |
| D. | Al2O3和MgO的熔点均很高,可用于制作耐高温材料 |
1.分子式为C4H8O2且能与氢氧化钠溶液反应的有机物(不考虑立体异构)有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
19.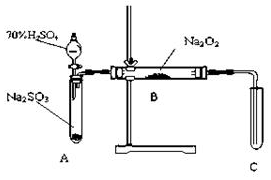 化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,作用产生二氧化硫没有干燥,水蒸气会与Na2O2反应.
②措施:为确保C中的实验现象发生,在B、C之间加一个装有NaOH溶液的洗气瓶,作用除去SO2气体防止污染空气.
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是2Na2O2+2CO2=2Na2CO3+O2.
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3mol•L-1HCl、6mol•L-1HNO3、NaOH稀溶液、蒸馏水、1mol•L-1 BaCl2溶液、澄清石灰水、品红溶液.
①提出合理假设:
假设1:白色固体为Na2SO3; 假设2:白色固体为Na2SO4 ;
假设3:白色固体为Na2SO3与Na2SO4的混合物.
②设计实验方案证明以上三种假设,并按表格式写出实验操作步骤、预期现象与结论.
 化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,作用产生二氧化硫没有干燥,水蒸气会与Na2O2反应.
②措施:为确保C中的实验现象发生,在B、C之间加一个装有NaOH溶液的洗气瓶,作用除去SO2气体防止污染空气.
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是2Na2O2+2CO2=2Na2CO3+O2.
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3mol•L-1HCl、6mol•L-1HNO3、NaOH稀溶液、蒸馏水、1mol•L-1 BaCl2溶液、澄清石灰水、品红溶液.
①提出合理假设:
假设1:白色固体为Na2SO3; 假设2:白色固体为Na2SO4 ;
假设3:白色固体为Na2SO3与Na2SO4的混合物.
②设计实验方案证明以上三种假设,并按表格式写出实验操作步骤、预期现象与结论.
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量白色固体于试管,加入过量3mol•L-1的稀盐酸,塞上单孔胶塞,将生成的气体通入品红溶液. | 若有能使品红溶液褪色的无色气体生成,说明白色固体含有Na2SO3,则假设1或3成立,若无该现象,则假设2成立. |
| 步骤2:在步骤1反应后的溶液加入1mol•L-1BaCl2溶液. | 若有白色沉淀生成,则说明白色固体含Na2SO4. 结合步骤1的结论,则假设3成立,若无该现象,则假设1成立. |
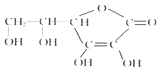 维生素C的结构简式如图所示:
维生素C的结构简式如图所示: