题目内容
9.下列有关物质的分类正确的是( )| A. | 混合物:水玻璃、碱石灰、明矾 | B. | 酸:稀硫酸、次氯酸、硫酸氢钠 | ||
| C. | 酸性氧化物:SO2、CO2、SiO2 | D. | 碱性氧化物:CaO、Na2O2、K2O |
分析 A、由两种或以上物质构成的为混合物;
B、电离出的阳离子全部是氢离子的化合物为酸;
C、能和碱反应生成盐和水的氧化物为酸性氧化物;
D、能和酸反应生成盐和水的氧化物为碱性氧化物.
解答 解:A、由两种或以上物质构成的为混合物,而明矾是KAl(SO4)2•12H2O,是纯净物,故A错误;
B、电离出的阳离子全部是氢离子的化合物为酸,而稀硫酸是混合物,不是化合物,故不是酸;硫酸氢钠电离出的阳离子不全部是氢离子,故也不是酸,故B错误;
C、能和碱反应生成盐和水的氧化物为酸性氧化物,二氧化硫、二氧化碳和二氧化硅均为酸性氧化物,故C正确;
D、能和酸反应生成盐和水的氧化物为碱性氧化物,而过氧化钠和酸反应时,除了生成盐和水,还生成氧气,故不是碱性氧化物,故D错误.
故选C.
点评 本题考查了物质的分类和常见的化学概念,应注意酸性氧化物和碱性氧化物的概念的辨析.

练习册系列答案
相关题目
19.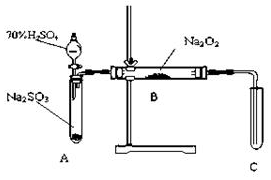 化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,作用产生二氧化硫没有干燥,水蒸气会与Na2O2反应.
②措施:为确保C中的实验现象发生,在B、C之间加一个装有NaOH溶液的洗气瓶,作用除去SO2气体防止污染空气.
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是2Na2O2+2CO2=2Na2CO3+O2.
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3mol•L-1HCl、6mol•L-1HNO3、NaOH稀溶液、蒸馏水、1mol•L-1 BaCl2溶液、澄清石灰水、品红溶液.
①提出合理假设:
假设1:白色固体为Na2SO3; 假设2:白色固体为Na2SO4 ;
假设3:白色固体为Na2SO3与Na2SO4的混合物.
②设计实验方案证明以上三种假设,并按表格式写出实验操作步骤、预期现象与结论.
 化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,作用产生二氧化硫没有干燥,水蒸气会与Na2O2反应.
②措施:为确保C中的实验现象发生,在B、C之间加一个装有NaOH溶液的洗气瓶,作用除去SO2气体防止污染空气.
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是2Na2O2+2CO2=2Na2CO3+O2.
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3mol•L-1HCl、6mol•L-1HNO3、NaOH稀溶液、蒸馏水、1mol•L-1 BaCl2溶液、澄清石灰水、品红溶液.
①提出合理假设:
假设1:白色固体为Na2SO3; 假设2:白色固体为Na2SO4 ;
假设3:白色固体为Na2SO3与Na2SO4的混合物.
②设计实验方案证明以上三种假设,并按表格式写出实验操作步骤、预期现象与结论.
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量白色固体于试管,加入过量3mol•L-1的稀盐酸,塞上单孔胶塞,将生成的气体通入品红溶液. | 若有能使品红溶液褪色的无色气体生成,说明白色固体含有Na2SO3,则假设1或3成立,若无该现象,则假设2成立. |
| 步骤2:在步骤1反应后的溶液加入1mol•L-1BaCl2溶液. | 若有白色沉淀生成,则说明白色固体含Na2SO4. 结合步骤1的结论,则假设3成立,若无该现象,则假设1成立. |
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氦原子的氦气的物质的量为2摩尔 | |
| B. | 2摩尔水的摩尔质量是1摩尔水的摩尔质量的2倍 | |
| C. | 25℃,1.01×105Pa,64g的SO2中含有的原子数为3NA | |
| D. | 1摩尔任何物质所含的分子数均为NA |
14.体育比赛中,当运动员肌肉挫伤或扭伤时,队医随即对准运动员的受伤部分喷射药剂氯乙烷(沸点为12.27℃)进行局部冷冻麻醉应急处理.制取氯乙烷最好的方法是( )
| A. | 乙烷跟氯气发生取代反应 | B. | 乙烯跟氯气发生加成反应 | ||
| C. | 乙烷跟氯化氢混合 | D. | 乙烯跟氯化氢发生加成反应 |
18.用含钴废料(含CoCO3、少量NiCO3与铁屑)制备CoCl2•6H2O的工艺流程如图1:
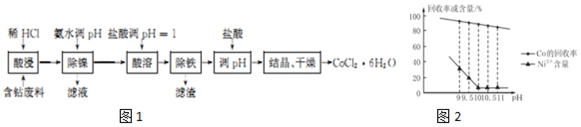
已知:除镍过程中溶液pH对Co的冋收率影响如图2所示;部分金属离子在实验条件下开始沉淀和完全沉淀的pH如表所示.
(1)酸浸工艺中用“稀HCl”替代了传统的“盐酸与硝酸的混酸”,其优点为减少有毒气体氮氧化物的排放;防止产品中混有硝酸盐(或防止将Co2+氧化).
(2)除镍时应调节pH=10;此步骤中Ni2+是否形成Ni(OH)2沉淀?否.
(3)除铁过程包括以下多个步骤:①向溶液中滴加适量30%H2O2,使其充分反应;②向溶液中加入CoCO3,调节溶液pH4.l≤pH<6.6,使Fe3+沉淀完全;③过滤得CoCl2溶液. (可供选用的试剂:30% H2O2、l.0mol•L-1KMnO4、NaOH固体、CoCO3固体)
(4)除铁后加入盐酸调pH的作用是抑制Co2+水解.
(5)工业上采用减压蒸干的方法制备CoCl2•6H2O,减压蒸干的目的是防止CoCl2•6H2O分解.

已知:除镍过程中溶液pH对Co的冋收率影响如图2所示;部分金属离子在实验条件下开始沉淀和完全沉淀的pH如表所示.
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 4.1 |
| Fe2+ | 7.5 | 9.7 |
| Co2+ | 6.6 | 9.4 |
| Ni2+ | 6.7 | 9.5 |
(2)除镍时应调节pH=10;此步骤中Ni2+是否形成Ni(OH)2沉淀?否.
(3)除铁过程包括以下多个步骤:①向溶液中滴加适量30%H2O2,使其充分反应;②向溶液中加入CoCO3,调节溶液pH4.l≤pH<6.6,使Fe3+沉淀完全;③过滤得CoCl2溶液. (可供选用的试剂:30% H2O2、l.0mol•L-1KMnO4、NaOH固体、CoCO3固体)
(4)除铁后加入盐酸调pH的作用是抑制Co2+水解.
(5)工业上采用减压蒸干的方法制备CoCl2•6H2O,减压蒸干的目的是防止CoCl2•6H2O分解.
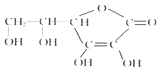 维生素C的结构简式如图所示:
维生素C的结构简式如图所示: 磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答: .
. 在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为0.1mol/L.
在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为0.1mol/L.