题目内容
15.焙烧产生的SO2可用于制硫酸.已知25℃、101kPa时:2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol;
H2O(g)?H2O(l)△H2=-44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol.
则:①2mol SO2(g)和1molO2(g)在密闭容器中充分反应所放出的热量<197kJ(填“>”、“<”或“=”)
②反应SO3(g)+H2O(l)═H2SO4(l)的焓变(△H)=-130kJ/mol.
分析 (1)反应2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol为可逆反应,则2mol SO2(g)和1molO2(g)在密闭容器中充分反应生成三氧化硫的物质的量小于2mol,放出热量小于197kJ;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol、②H2O(g)?H2O(l)△H2=-44kJ/mol、③2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol,根据盖斯定律$\frac{1}{2}$(③-①-②×2)可得SO3(g)+H2O(l)═H2SO4(l),据此进行计算即可.
解答 解:(1)根据2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol可知,生成2mol三氧化硫会放出197kJ热量;由于该反应为可逆反应,2mol SO2(g)和1molO2(g)在密闭容器中充分反应生成SO3的物质的量小于2mol,则放出的热量会小于197kJ,
故答案为:<;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol;
②H2O(g)?H2O(l)△H2=-44kJ/mol;
③2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol
根据盖斯定律$\frac{1}{2}$(③-①-②×2)可得:SO3(g)+H2O(l)═H2SO4(l)△H=$\frac{1}{2}$(△H3-△H1-2△H2)=-130 kJ/mol,
故答案为:-130 kJ/mol.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确可逆反应特点为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及化学计算能力.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
(2)填表:(类别选填“单质”、“氧化物”、“酸”、“碱”、“盐:
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
| A. | H++OH -=H2O | |
| B. | Cl -+Ag+=AgCl↓ | |
| C. | Cu 2++2OH -+Ba 2++SO42-=BaSO4↓+Cu(OH)2↓ | |
| D. | H++SO42-+OH-+Ba 2+=BaSO4↓+H2O |
| A. | 含有NA个氦原子的氦气的物质的量为2摩尔 | |
| B. | 2摩尔水的摩尔质量是1摩尔水的摩尔质量的2倍 | |
| C. | 25℃,1.01×105Pa,64g的SO2中含有的原子数为3NA | |
| D. | 1摩尔任何物质所含的分子数均为NA |
| A. | Cl、S、P | B. | N、O、F | C. | Na+、Mg2+、Al3+ | D. | K、Na、Li |
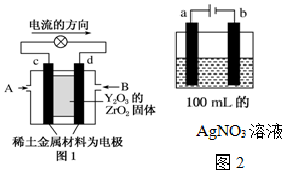 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).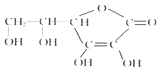 维生素C的结构简式如图所示:
维生素C的结构简式如图所示: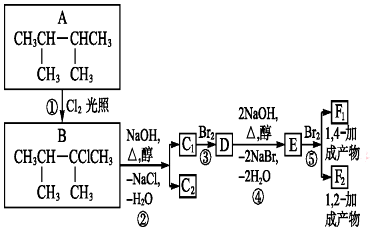
 .
. ;F1的结构简式是
;F1的结构简式是 .
.