题目内容
20.如图中,甲装置为CH3OH、O2、KOH三者构成的燃烧电池,其电极均为Pt电极.装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液.(1)甲装置中B极是正极 (填“正、负”)
(2)写出甲装置中A极的电极反应式CH3OH+8OH--6e-=CO32-+6H2O
(3)乙装置中SO42-将移向C电极 (填“C、D”)
(4)写出乙装置中C极的电极反应式PbSO4+2H2O-2e-=PbO2+SO42-+4H+,
(5)当有32克CH3OH参加反应时,D电极的质量变化为288克.

分析 甲醇燃料碱性电池中,加入燃料的电极是负极,即A为负极,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,正极上通入氧气,即B为正极,正极上氧气得电子和水反应生成氢氧根离子;乙装置为电解池,C与正极相连为阳极,阳极上硫酸铅失电子生成二氧化铅,D为阴极,阴极上硫酸铅得电子生成Pb,结合得失电子守恒计算.
解答 解:(1)甲醇燃料碱性电池中,加入燃料的电极是负极,即A为负极,正极上通入氧气,即B为正极,故答案为:正;
(2)A为负极,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,其反应式为:CH3OH+8OH--6e-=CO32-+6H2O;
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(3)乙装置为电解池,电解时阴离子向阳极移动,则SO42-将移向C极移动,故答案为:C;
(4)C与正极相连为阳极,阳极上硫酸铅失电子生成二氧化铅,其电极方程式为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+,
故答案为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+;
(5)当有32克即1molCH3OH参加反应时,由CH3OH+8OH--6e-=CO32-+6H2O可知,转移电子为6mol,D为阴极,阴极上硫酸铅得电子生成Pb阴极反应式为PbSO4+2e-=Pb+SO42-,由电子守恒可知,生成Pb为3mol,阴极上PbSO4转化Pb,则电极减少的质量为硫酸根离子的质量,为3mol×96g/mol=288g,
故答案为:288.
点评 本题考查了燃料电池和电解池,题目难度中等,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,注意结合电解质溶液酸碱性书写,侧重于考查学生的分析能力.

练习册系列答案
相关题目
11.关于如图所示装置的叙述,正确的是( )
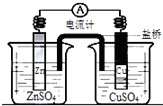

| A. | 铜是阳极,铜片上有气泡产生 | |
| B. | 锌离子在锌片表面被还原 | |
| C. | 正极附近的SO${\;}_{4}^{2-}$离子浓度逐渐增大 | |
| D. | 盐桥中的阳离子会移向CuSO4溶液 |
8.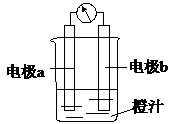 课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )
课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )
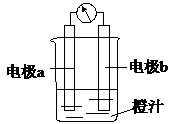 课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )
课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )| A. | 原电池是将化学能转化成电能的装置 | |
| B. | 原电池由电极、电解质溶液和导线等组成 | |
| C. | 右图中a极为镁条、b极为锌片时,导线中会产生电流 | |
| D. | 右图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
15.下列说法正确的是( )
| A. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| B. | 一个化学反应是吸热还是放热,取决于反应物和生成物总能量的相对大小 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
5.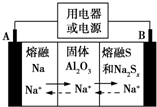 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 放电时,电极A为负极,Na+由B向A移动 | |
| B. | 放电时,负极反应式为2Na-xe-═2Na+ | |
| C. | 充电时,电极B的反应式为S2--2e-═xS | |
| D. | 充电时,电极B接电源的负极 |
12.下列关于有机物的说法正确的是( )
| A. | 汽油、煤油、植物油均为含碳氢氧三种元素的化合物 | |
| B. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,且都有同分异构体 | |
| C. | 乙酸与丙二酸互为同系物 | |
| D. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 |
9.下列有关硅及其化合物用途的说法中,正确的是( )
| A. | 二氧化硅是制造光电池的主要原料 | |
| B. | 硅是现代光学及光纤制品的基本原料 | |
| C. | 可用石英坩埚加热氢氧化钠固体 | |
| D. | 在电子工业中,硅是重要的半导体材料 |
10.某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1.滴入几滴石蕊溶液后,用石墨作电极电解该混合溶液,根据电极产物,电解过程可明显分为三个阶段.下列叙述中,不正确的是( )
| A. | 电解过程中,Na+和SO42-的物质的量浓度保持不变 | |
| B. | 电解过程中,溶液颜色呈现红色→紫色→蓝色的变化 | |
| C. | 阴极产生的气体自始至终只有H2 | |
| D. | 第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl |