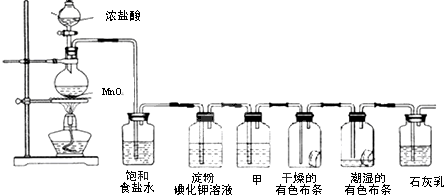
题目内容
11.关于如图所示装置的叙述,正确的是( )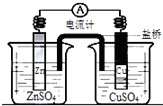
| A. | 铜是阳极,铜片上有气泡产生 | |
| B. | 锌离子在锌片表面被还原 | |
| C. | 正极附近的SO${\;}_{4}^{2-}$离子浓度逐渐增大 | |
| D. | 盐桥中的阳离子会移向CuSO4溶液 |
分析 该反应能自发进行,所以该装置是原电池,根据电子流向知,锌作负极,铜作正极,负极上锌失电子发生氧化反应,正极上铜离子得电子发生还原反应,根据原电池的工作原理来回答.
解答 解:A.该反应能自发进行,所以该装置是原电池,根据电子流向知,锌作负极,铜作正极,铜电极上铜离子得电子生成铜,故A错误;
B.该原电池中,铜电极上铜离子得电子生成铜,在锌片表面是金属锌失电子被氧化,故B错误;
C.该原电池中,硫酸根离子移向负极,负极附近硫酸根离子浓度增加,故C错误;
D.该原电池中,锌作负极,金属铜是正极,阳离子移向正极,即盐桥中阳离子会移向CuSO4溶液,故D正确;
故选D.
点评 本题考查了原电池原理,正确推断原电池及正负极是解本题关键,结合正负极上发生的电极反应、电流流向来分析解答即可,难度不大.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 用碱式滴定管取23.10mL溴水 | |
| B. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| C. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |


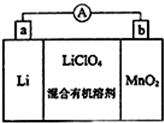 锰及其化合物在现代工业及国防建设中具有十分重要的地位.
锰及其化合物在现代工业及国防建设中具有十分重要的地位.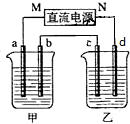 如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.