题目内容
10.硝酸是一种重要的化工原料,工业上生产硝酸的过程如下:(1)以氮气、氢气为原料合成氨
①下列措施可以提高H2的转化率是(填选项序号)bc.
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的$\frac{15}{16}$,则N2的转化率a1=12.5%;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2>a1(填“>”、“<”或“=”)
(2)以氨气、空气为主要原料制硝酸.
在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)ad.
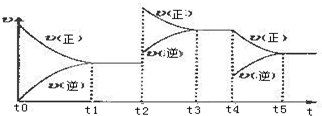
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.7kJ/mol.
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.
分析 (1)①可以提高H2的转化率的措施就是使得化学平衡正向移动的措施,但是不能是加入氢气;
②依据化学平衡三段式列式计算,气体压强之比等于气体物质的量之比,转化率=$\frac{消耗量}{起始量}$×100%;随着反应的进行,气体的物质的量减小,所以压强减小,保持恒压,则相当于在恒容的基础上加压,即正向移动建立新平衡;
(2)a.反应是前后系数和变化的反应,可依据容器内气体的压强保持不变判断反应已达到平衡状态;
b.在t2时,正逆反应速率加快,平衡正向移动,据此确定采取的措施;
c.容器内气体的密度等于气体质量和体积的比值,始终是保持不变的量不能作为判断反应达到平衡状态的方面;
d.根据影响因素和平衡移动的方向确定容器内NO2的体积分数的最大值;
(3)已知:Ⅰ、2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol
Ⅱ、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
由盖斯定律可知,Ⅰ×2-Ⅱ得4H2(g)+2NO2(g)=N2(g)+4H2O(g),据此计算.
解答 解:(1)①a.选择适当的催化剂,不会引起化学平衡的移动,故错误;
b.增大压强,可以促使化学平衡正向移动,可以提高H2的转化率,故正确;
c.及时分离生成的NH3,可以促使化学平衡正向移动,可以提高H2的转化率,故正确;
d.升高温度会使得化学平衡逆向移动,降低反应物的转化率,故D错误;
故选:bc.
②一定温度下,在1L密闭容器中充入1mol N2和3mol H2并发生反应.若容器容积恒定,达到平衡时,气体的总压强为原来的$\frac{15}{16}$,依据化学平衡三段式列式计算,设氮气消耗物质的量为x;
N2+3H2=2NH3
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
$\frac{1-x+3-3x+2x}{4}$=$\frac{15}{16}$,解得:x=0.125mol
则N2的转化率α(N2)=$\frac{0.125mol}{1mol}$×100%=12.5%;随着反应的进行,气体的物质的量减小,所以压强减小,保持恒压,则相当于在恒容的基础上加压,正向移动建立新平衡,所以反应物的转化率增加,即a2>a1,
故答案为:12.5%;>;
(2)a.反应是前后系数和变化的反应,可依据容器内气体的压强保持不变判断反应已达到平衡状态,故正确;
b.在t2时,正逆反应速率加快,平衡正向移动,采取的措施可以是升高温度,还可以是加压,故错误;
c.容器内气体的密度等于气体质量和体积的比值,始终是保持不变的量,所以密度不变的时候反应不一定达到平衡状态,故错误;
d.根据影响因素引起的都是平衡正向移动,所以容器内NO2的体积分数始终是减小的,即在t3时容器内NO2的体积分数在t3时值的最大,故正确.
故选:ad;
(3)已知:Ⅰ、2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol
Ⅱ、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
由盖斯定律可知,Ⅰ×2-Ⅱ得4H2(g)+2NO2(g)=N2(g)+4H2O(g),
故△H=2×(-483.5kJ/mol)-67.7kJ/mol=-1100kJ/mol,
故热化学方程式为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.7kJ/mol,
故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.7kJ/mol.
点评 本题考察范围广,难度大,主要考查了平衡移动、平衡计算、盖斯定律、电化学相关知识,注意知识的梳理应用是关键.

| A. | 处理过程中银器一直保持恒重 | |
| B. | 正极的电极反应为Ag2S-2e-═2Ag++S | |
| C. | 该过程中铝是负极,发生氧化反应 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色AgCl |


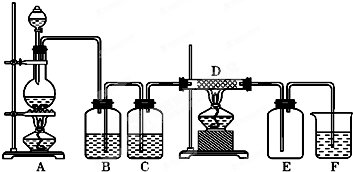 如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.
如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.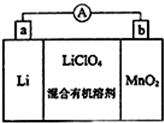 锰及其化合物在现代工业及国防建设中具有十分重要的地位.
锰及其化合物在现代工业及国防建设中具有十分重要的地位.