题目内容
5.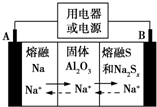 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 放电时,电极A为负极,Na+由B向A移动 | |
| B. | 放电时,负极反应式为2Na-xe-═2Na+ | |
| C. | 充电时,电极B的反应式为S2--2e-═xS | |
| D. | 充电时,电极B接电源的负极 |
分析 根据图片知,放电时,Na失电子发生氧化反应,所以A作负极、B作正极,负极反应式为2Na-2e-═2Na+、正极反应式为xS+2e-═Sx2-,充电时A为阳极、B为阴极,阴极、阳极电极反应式与负极、正极反应式正好相反,放电时,电解质中阳离子向正极移动、阴离子向负极移动.
解答 解:根据图片知,放电时,Na失电子发生氧化反应,所以A作负极、B作正极,负极反应式为2Na-2e-═2Na+、正极反应式为xS+2e-═Sx2-,充电时A为阳极、B为阴极,阴极、阳极电极反应式与负极、正极反应式正好相反,放电时,电解质中阳离子向正极移动、阴离子向负极移动,
A、放电时,Na失电子发生氧化反应,所以A作负极、B作正极,电解质中阳离子钠离子向正极B移动,故A错误;
B、放电时,负极反应式为2Na-2e-═2Na+,故B错误;
C、充电时,B是阳极,电极反应式为Sx2--2e-═xS,故C正确;
D、充电时A是阴极,应该连接电源负极,电极B接电源的正极,故D错误;
故选C.
点评 本题考查化学电源新型电池,正确获取图片提供信息是解本题关键,根据得失电子确定正负极、阴阳极,难点是电极反应式的书写,题目难度中等.

练习册系列答案
相关题目
17.下列物质属于非电解质的是( )
| A. | 硫酸 | B. | 氨水 | C. | 酒精 | D. | 铜 |
15.电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO${\;}_{3}^{-}$的原理如图所示,下列说法不正确的是( )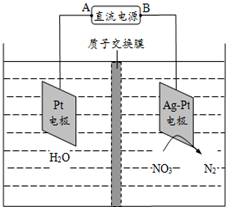

| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| C. | 该电解池的总反应方程式为:2H2O+4NO3-$\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
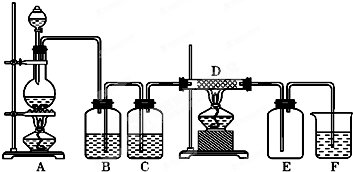 如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.
如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.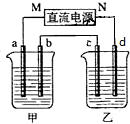 如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.

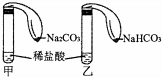 为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).
为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).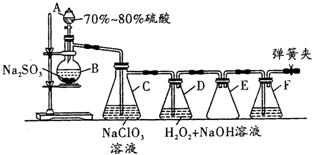 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.