题目内容
18.在1L 2mol•L-1的稀硝酸中加入一定量的铜粉,充分反应后溶液的质量增加了13.2g,问:(1)加入的铜粉是多少克?
(2)理论上可产生NO气体多少升(标准状况下)?
分析 根据反应方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,投入铜溶液质量增加,生成一氧化氮气体溶液质量减轻,结合质量增加了13.2g,分析求解.
解答 解:设加入的铜粉质量为x,生成的NO质量为y
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
192 60
x y
则:$\left\{\begin{array}{l}{\frac{192}{x}=\frac{60}{y}}\\{x-y=13.2}\end{array}\right.$ 可得x=19.2g
y=6g,所以生成一氧化氮的体积为:$\frac{6g}{30g/mol}×22.4L/mol$=4.48L,
答:(1)加入铜粉的质量是19.2g;
(2)理论上产生NO的体积是4.48L(标况下).
点评 本题考查根据化学反应的原理结合溶液质量的变化,列出关系式进行计算,比较容易.

练习册系列答案
相关题目
8.下列关于离子共存或离子反应的说法正确的是( )
| A. | 碱性溶液中可能大量存在Na+、I-、SO42-、ClO- | |
| B. | 弱碱性溶液中可能大量存在K+、Cl-、HCO3-、AlO2- | |
| C. | Fe(NO3)3溶液中加入足量HI溶液的反应:2Fe3++2I-=2Fe2++I2 | |
| D. | 向白色ZnS沉淀上滴加CuSO4溶液,白色沉淀变黑的离子方程式:ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq) |
6.下列不能发生银镜反应的物质是( )
| A. | 甲酸 | B. | 乙醛 | C. | 甘油 | D. | 果糖 |
13.最新研究表明,以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,下列有关说法正确的是( )
| A. | 乙酸是非电解质 | |
| B. | 上述制备乙酸的化学方程式为CO2+CH4$\stackrel{Cu_{2}Al_{2}O_{2}}{→}$CH3COOH | |
| C. | 上述制备乙酸的反应中原子利用率为80% | |
| D. | 乙酸没有同分异构体 |
4.下列有关气体体积的描述中正确的是( )
| A. | 标准状况下,22.4LCCl4含有的分子数约为6.02×1023个 | |
| B. | 1L氢气一定比1L氧气质量少 | |
| C. | 含有6.02×1023个Fe3+的Fe2(SO4)3中SO42-的物质的量为3mol | |
| D. | 1molAl3+带有的正电荷数为3NA |
11.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确是( )
| A. | 标准状况下,反应过程中得到6.72L的气体 | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(Na+)=1.5 mol•L-1 |
8.某研究小组为了验证反应物浓度对反应速率的影响,选用硫酸酸化的高锰酸钾溶液与草酸溶液在室温下进行反应.
实验中所用的草酸为稀溶液,可视为强酸.
(1)将高锰酸钾氧化草酸的离子方程式补充完整.
2MnO4-+5C2O42-+16H+=2 Mn2++10CO2↑+8H2O
(2)该小组进行了实验I,数据如表.
一般来说,其他条件相同时,增大反应物浓度,反应速率.
但分析实验数据,得到的结论是在当前实验条件下,增大草酸浓度,反应速率减小.
(3)该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如图.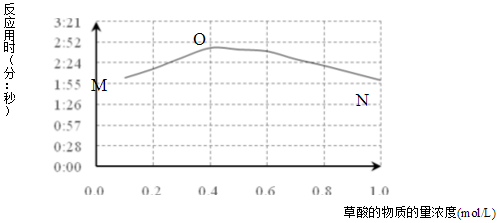
①用文字描述曲线图表达的信息当草酸浓度小于0.4mol/L时,反应速率随着草酸浓度增加而减小,当草酸浓度大于0.4mol/L时,反应速率随着草酸浓度增加而增加.
②该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是ab.
(4)该小组为探究ON段曲线变化趋势的原因,又进行了实验III,所得数据如表.
该小组进行实验III的目的是小组进行实验III的目的是探究其他离子浓度不变,溶液中H+浓度对反应速率的影响;.
(5)综合实验I、II、III,推测造成曲线MN变化趋势的原因.为验证该推测还需要补充实验,请对实验方案进行理论设计.
实验中所用的草酸为稀溶液,可视为强酸.
(1)将高锰酸钾氧化草酸的离子方程式补充完整.
2MnO4-+5C2O42-+16H+=2 Mn2++10CO2↑+8H2O
(2)该小组进行了实验I,数据如表.
| H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
但分析实验数据,得到的结论是在当前实验条件下,增大草酸浓度,反应速率减小.
(3)该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如图.

①用文字描述曲线图表达的信息当草酸浓度小于0.4mol/L时,反应速率随着草酸浓度增加而减小,当草酸浓度大于0.4mol/L时,反应速率随着草酸浓度增加而增加.
②该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是ab.
| a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II).(括号中罗马数字表示锰的化合价) |
| b | 草酸根易与不同价态锰离子形成较稳定的配位化合物. |
| c | 草酸稳定性较差,加热至185℃可分解. |
| H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
| 1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
| 1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
| 1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
(5)综合实验I、II、III,推测造成曲线MN变化趋势的原因.为验证该推测还需要补充实验,请对实验方案进行理论设计.
9.2016年化学领域重要成果之一是丹麦制药公司LEO Pharma与美国斯克里普斯研究所(The Scripps Research Institute)的Phil S.Baran课题组合作,成功地将合成巨大戟醇(分子式为C20HxO5)的步骤由37步缩短至14步.巨大戟醇是合成治疗日光性角化病药物(Picato)的原料.

下列说法错误的是( )

下列说法错误的是( )
| A. | 由巨大戟醇制备Picato药物的反应是酯化反应 | |
| B. | 由巨大戟醇制备Picato药物的另一种反应物是CH3C═CHCOOH | |
| C. | 0.1 mol巨大戟醇完全燃烧消耗2.45 molO2 | |
| D. | 巨大戟醇能发生取代反应、氧化反应、加成反应 |