题目内容
2.下列说法正确的是( )| A. | 某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红的气体,则原溶液中存在NH4+ | |
| B. | 某溶液中加入硝酸银溶液时,产生白色沉淀,说明原溶液中含有Cl- | |
| C. | 向溶液中加入稀盐酸,生成能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含CO32- | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,原溶液可能存在Ag+或SO42-或CO32-或SO32- |
分析 A.氨气可使红色石蕊试纸变蓝色;
B.可能生成碳酸银、硫酸银沉淀;
C.可能含有HCO3-;
D.某溶液中加入BaCl2溶液时,产生白色沉淀,可能生成氯化银、硫酸银、碳酸银、碳酸钡、硫酸钡以及亚硫酸钡等沉淀.
解答 解:A.与NaOH溶液共热,产生使湿润红色的石蕊试纸变蓝的气体,说明原溶液中存在NH4+,而不是使蓝色的石蕊试纸变红,故A错误;
B.加入AgNO3溶液有白色沉淀出现,可能生成碳酸银、硫酸银等,因先加入硝酸酸化,故B错误;
C.某固体在加入稀盐酸后产生了无色无味且能使澄清石灰水变浑的气体,该气体为二氧化碳,该固体中可能含有HCO3-,不一定含有CO32-,故C错误;
D.某溶液中加入BaCl2溶液时,产生白色沉淀,可能生成氯化银、硫酸银、碳酸银、碳酸钡、硫酸钡以及亚硫酸钡等沉淀,可能含有Ag+或SO42-或CO32-或SO32-,故D正确.
故选D.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的严密性、可行性的评价,难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
12.下列关于碳酸钠和碳酸氢钠的比较中,正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 碱性:Na2CO3<NaHCO3 | |
| C. | 水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 与足量的盐酸反应产生的气体的体积:Na2CO3<NaHCO3 |
13.有一份溶液中只有K+、Na+、NO3-、CO32-四种离子大量存在,经测定,c(Na+)=2.0mol/L,c(K+)=2.5mol/L,c(CO32-)=1.8mol/L,则溶液中NO3-的物质的量浓度为( )
| A. | 2.7 mol/L | B. | 1.35 mol/L | C. | 0.9 mol/L | D. | 0.45 mol/L |
10.下列有关钠和镁的说法中,不正确的是( )
| A. | 电解饱和食盐水可以得到氯气 | |
| B. | 金属钠在高温下能将TiCl4中的钛置换出来 | |
| C. | 金属镁燃烧后会发出耀眼的白光,因此常用来制造信号弹和焰火 | |
| D. | 金属镁着火,可用二氧化碳灭火 |
14.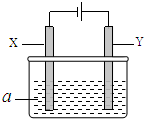 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.
请回答以下问题:
(1)X的电极名称是阴极(填写“阳极”或“阴极”).
(2)若X、Y都是惰性电极,a是硫酸钠溶液,实验开始时,同时在两边各滴入几滴紫色石蕊试液,一段时间后,在X极附近观察到的现象是溶液变为红色,Y极上的电极反应式为4OH--4e-=H2O+O2↑.
(3)若X、Y都是惰性电极,a是AgNO3溶液,电解一段时间后,阳极上产
生气体的体积为0.448L(标准状况下),则阴极上析出金属的质量为8.64g.
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则Y电极的材料是粗铜,X电极的材料是精铜.
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是C.
 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)X的电极名称是阴极(填写“阳极”或“阴极”).
(2)若X、Y都是惰性电极,a是硫酸钠溶液,实验开始时,同时在两边各滴入几滴紫色石蕊试液,一段时间后,在X极附近观察到的现象是溶液变为红色,Y极上的电极反应式为4OH--4e-=H2O+O2↑.
(3)若X、Y都是惰性电极,a是AgNO3溶液,电解一段时间后,阳极上产
生气体的体积为0.448L(标准状况下),则阴极上析出金属的质量为8.64g.
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则Y电极的材料是粗铜,X电极的材料是精铜.
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是C.
| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | AgNO3 |
| D | 铁 | 银 | Fe(NO3)3 |
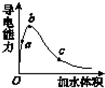 在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题.
在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题.