题目内容
17.物质结构揭示物质构成的奥秘,请回答以下问题:(1)元素A含有8个质子,10个中子的核素,用核素符号表示为188O.元素B被科学家称“防癌之王”,与元素A同主族位于第四周期,元素B的名称为硒,A和B的氢化物,沸点较高的是H2O(填化学式).
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为C>H>Si.
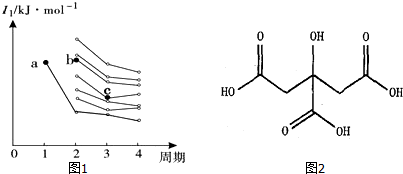
(3)如图1是前四周期主族元素第一电离能梯度图,图中a点对应的元素为氢,则b点对应元素的未成对电子数为3,c点对应元素基态原子核外电子排布式为1s22s22p63s23p4.
(4)FeC13晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因是FeCl3为分子晶体,FeF3为离子晶体,离子晶体的熔点高于分子晶体.
(5)水果中含有不同的果酸,其中柠檬、柑橘等水果中含有柠檬酸,柠檬酸的结构如图2.柠檬酸的晶体类型为分子晶体,碳原子的杂化轨道类型为sp2、sp3;柠檬酸晶体中含有的作用力有共价键、氢键、范德华力.
分析 (1)元素A含有8个质子,则为O元素,原子符号AZX中,左下角Z为质子数,左上角A为质量数,X为元素符号,其中质量数=质子数+中子数;
B与元素A同主族位于第四周期,则B为硒,水分子之间存在氢键,沸点较高;
(2)电负性越大,对键合电子吸引越强,元素表现负化合价,电负性小的元素表现正化合价,同主族自上而下电负性减小;
(3)同周期随原子序数增大,第一电离能呈增大趋势,但IIA族、VA族第一电离能高于同周期相邻元素,b处于第二周期,c处于第三周期,由图中第一电离能可知b为O元素、c为Si;
(4)FeCl3为分子晶体,FeF3为离子晶体;
(5)柠檬酸属于分子晶体,羧基中C原子形成3个σ键,其它碳原子形成4个σ键;
柠檬酸分子内存在共价键,分子之间存在范德华力、氢键.
解答 解:(1)元素A含有8个质子,则为O元素,且含有10个中子,则质量数为18,故该核素符号为188O,B与元素A同主族位于第四周期,则B为硒,水分子之间存在氢键,而硒化氢之间为范德华力,氢键比较范德华力更强,故水的沸点较高,
故答案为:188O;硒;H2O;
(2)CH4中共用电子对偏向C,说明C元素电负性更大,SiH4中硅元素为+4价,则H元素电负性比Si的大,故电负性:C>H>Si,
故答案为:C>H>Si;
(3)同周期随原子序数增大,第一电离能呈增大趋势,但IIA族、VA族第一电离能高于同周期相邻元素,b处于第二周期,c处于第三周期,由图中第一电离能可知b为O元素、c为Si,N元素外围电子排布为2s22p3,有3个未成对电子,Si原子核外电子排布为:1s22s22p63s23p4,
故答案为:3;1s22s22p63s23p4;
(4)FeCl3为分子晶体,FeF3为离子晶体,离子晶体的熔点高于分子晶体,两种化合物熔点差异较大,
故答案为:FeCl3为分子晶体,FeF3为离子晶体,离子晶体的熔点高于分子晶体;
(5)柠檬酸属于分子晶体,羧基中C原子形成3个σ键,其它碳原子形成4个σ键,碳原子杂化方式为:sp2、sp3;柠檬酸分子内存在共价键,分子之间存在范德华力、氢键,
故答案为:分子晶体;sp2、sp3;共价键、氢键、范德华力.
点评 本题是对物质结构的考查,涉及原子构成、元素周期表与元素周期律、电负性、电离能、晶体类型与性质、杂化方式、化学键、氢键等,注意对基础知识的理解掌握,难度中等.

| A. | 升高温度,溶液中c(OH-)降低 | B. | 加入少量NaOH固体,c(CO32-)增大 | ||
| C. | c(Na+)═2c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)+c(H+)═2c(CO32-)+2c(HCO3-)+c(OH-) |
| A. | 原子数 | B. | 分子数 | C. | 质量 | D. | 密度 |
| A. | 某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红的气体,则原溶液中存在NH4+ | |
| B. | 某溶液中加入硝酸银溶液时,产生白色沉淀,说明原溶液中含有Cl- | |
| C. | 向溶液中加入稀盐酸,生成能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含CO32- | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,原溶液可能存在Ag+或SO42-或CO32-或SO32- |
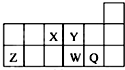
| A. | 元素Y的单质比元素X的单质更容易与氢气反应 | |
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| C. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
| A. | 向SO2 水溶液中滴加盐酸酸化的BaCl2 溶液,有白色沉淀生成,说明BaSO4难溶于盐酸 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| C. | 向0.1mol•L-1 FeSO4 溶液中滴加少量酸性KMnO4 溶液,紫红色KMnO4 溶液褪色,说明Fe2+具有还原性 | |
| D. | 向某溶液中滴加NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定不含NH4+ |
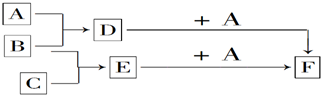
 .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.