题目内容
13.有一份溶液中只有K+、Na+、NO3-、CO32-四种离子大量存在,经测定,c(Na+)=2.0mol/L,c(K+)=2.5mol/L,c(CO32-)=1.8mol/L,则溶液中NO3-的物质的量浓度为( )| A. | 2.7 mol/L | B. | 1.35 mol/L | C. | 0.9 mol/L | D. | 0.45 mol/L |
分析 溶液中只有K+、Na+、NO3-、CO32-四种离子大量存在,阳离子所带正电荷的总浓度等于阴离子所带负电荷的总浓度,据此分析.
解答 解:有一份溶液中只有K+、Na+、NO3-、CO32-四种离子大量存在,经测定,c(Na+)=2.0mol/L,c(K+)=2.5mol/L,c(CO32-)=1.8mol/L,
则c(Na+)+c(K+)=2c(CO32-)+c(NO3-),则c(NO3-)=2.0mol/L+2.5mol/L-1.8mol/L×2=0.9 mol/L,
故选C.
点评 本题考查了溶液中离子浓度的计算,题目难度不大,侧重于基础知识的考查,注意把握溶液中电荷守恒在计算中的应用.

练习册系列答案
相关题目
3.根据表中的信息判断下列说法错误的是( )
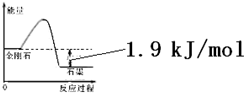
| 物质 | 外观 | 熔点 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色,透明固体 | ? | 395.4 |
| 石墨 | 灰黑,不透明固体 | ? | 393.5 |

| A. | 由表中信息可得如右图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol | |
| C. | 由表中信息可推知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 表示石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)=CO(g)△H=-393.5kJ/mol |
8.同温同压条件下,在两个容积相同的密闭容器中,一个盛有NH3,另一个盛有N2、H2的混合气体,两容器内的气体一定具有相同的( )
| A. | 原子数 | B. | 分子数 | C. | 质量 | D. | 密度 |
18.某一混合物的无色水溶液,只可能含有以下离子中的若干种:Na+、K+、Cu2+、Ba2+、Cl-、CO32-、SO42-,现取2份100mL溶液进行如下实验:
(1)第一份溶液中加入硝酸银溶液,有沉淀生成;
(2)第二份溶液中加入足量的氯化钡溶液后,过滤、常温干燥得4.30g沉淀,经盐酸洗涤干燥后,沉淀质量为2.33g.
根据上述实验事实,以下推断,正确的是( )
(1)第一份溶液中加入硝酸银溶液,有沉淀生成;
(2)第二份溶液中加入足量的氯化钡溶液后,过滤、常温干燥得4.30g沉淀,经盐酸洗涤干燥后,沉淀质量为2.33g.
根据上述实验事实,以下推断,正确的是( )
| A. | Ba2+一定不存在,Cu2+可能存在 | |
| B. | 一定存在Cl- | |
| C. | 100 mL溶液中含有0.02 mol的CO32- | |
| D. | c(Na+)+c(K+)≥0.4 mol/L |
2.下列说法正确的是( )
| A. | 某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红的气体,则原溶液中存在NH4+ | |
| B. | 某溶液中加入硝酸银溶液时,产生白色沉淀,说明原溶液中含有Cl- | |
| C. | 向溶液中加入稀盐酸,生成能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含CO32- | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,原溶液可能存在Ag+或SO42-或CO32-或SO32- |
3.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | 氢氧化钠与盐酸; 氢氧化钠与碳酸 | |
| B. | BaCl2溶液与Na2SO4溶液; Ba(OH)2溶液与H2SO4溶液 | |
| C. | Na2CO3溶液与硝酸溶液; CaCO3溶液与硝酸溶液 | |
| D. | 石灰石与硝酸反应; 石灰石与盐酸 |
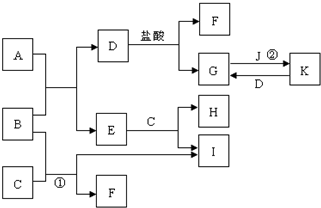 如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去. A俗称“铁红”,B、D都是日常生活中常见的金属,且B元素是地壳中含量最多的金属元素,常温下,J为黄绿色气体,H为无色气体;C是一种碱,且其焰色反应时,透过蓝色钴玻璃可观察到紫色火焰.
如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去. A俗称“铁红”,B、D都是日常生活中常见的金属,且B元素是地壳中含量最多的金属元素,常温下,J为黄绿色气体,H为无色气体;C是一种碱,且其焰色反应时,透过蓝色钴玻璃可观察到紫色火焰. .
.